Care sunt proprietățile columbative ale soluțiilor?
Soluțiile sunt sisteme omogene care conțin două sau mai multe componente, precum și produse care sunt rezultatul interacțiunii acestor componente. Ele pot fi într-o stare solidă, lichidă sau gazoasă. Să luăm în considerare starea de soluții agregate lichide. Compoziția lor include un solvent și o substanță dizolvată în acesta (ultima este mai mică).
Proprietățile colligative ale soluțiilor sunt caracteristicile lor, care depind direct de solvent și de concentrația soluției. Ele sunt numite și colective sau colective. Proprietățile colligative ale soluțiilor apar în amestecuri în care nu există nicio interacțiune chimică între componentele constituente. În plus, forțele de acțiune reciprocă dintre particulele solventului și particulele solventului și substanța dizolvată în el sunt egale în soluții ideale.
Proprietățile colligative ale soluțiilor:
1) Presiunea de vapori este mai mică decât soluția peste soluție.
2) Cristalizarea soluției are loc la o temperatură sub temperatura de cristalizare a solventului sub forma sa pură.
3) Încălzirea soluției are loc la o temperatură mai ridicată decât la fierberea solventului în sine.
4) Fenomenul de osmoză.

Luați în considerare separat proprietățile colligative.
Echilibrul la limita fazelor într-un sistem închis: vaporii lichizi sunt caracterizați prin presiune vapori saturați. Deoarece în soluția o parte a stratului de suprafață este umplută cu molecule ale substanței dizolvate, echilibrul va fi atins la o presiune a vaporilor mai scăzută.
Al doilea Collegiate proprietate - reducerea temperaturii de cristalizare comparativ cu solventul din soluția - datorită faptului că particulele de solut să împiedice construcția cristalelor, prevenind astfel cristalizarea la temperaturi scăzute.
Punctul de fierbere al amestecului este mai mare decât solventul într-o formă pură, datorită faptului că egalitatea presiunea atmosferică, iar presiunea de vapori este realizată la temperaturi ridicate, deoarece o parte din moleculele de solvent asociate cu particulele de solut.

A patra proprietate coluzitivă a soluțiilor este fenomenul de osmoză.
osmoza - abilitatea de a migra prin solventul de separare, care este permeabil pentru anumite particule (molecule de solvent) și impermeabil la alții (molecula solut). Acest sept separă soluția cu un conținut ridicat de substanță dizolvată dintr-o soluție mai puțin concentrată. Un exemplu de o astfel de partiție semipermeabil poate servi ca o membrană a unei celule vii, bovine, etc. cu bule. Fenomenul Osmoza cauzate de egalizare de concentrare pe ambele părți separate printr-o membrană care este termodinamic mai favorabil pentru sistem. Ca rezultat al deplasării solventului într-o soluție mai concentrată, se observă o creștere a presiunii în această parte a vasului. Asta este suprapresiune a fost numit osmotic.

Din punct de vedere matematic, proprietățile colligative ale soluțiilor nonlectroliților pot fi reprezentate prin ecuațiile:
Δ Tkip = Sketch ∙ Sm;
Δ Tcr. = Kzam ∙ Sm;
pi- = CRT.
Proprietățile colligative în termeni numerici diferă pentru soluțiile de electroliți și soluții de neelectroliți. Pentru prima, ele sunt ceva mai mari. Acest lucru se datorează faptului că acestea apar în disocierea electrolitică, și numărul de particule crește semnificativ.
Proprietățile colligative ale soluțiilor sunt utilizate pe scară largă în viața de zi cu zi și la locul de muncă, de exemplu, fenomenul de osmoză este folosit pentru producerea apei pure. În organismele vii, multe sisteme sunt, de asemenea, construite pe proprietățile colligative ale soluțiilor (de exemplu, creșterea celulelor de plante).
 Presiunea osmotică
Presiunea osmotică Concentrația de moleculă. Care este concentrația molară și molară?
Concentrația de moleculă. Care este concentrația molară și molară? În ce cazuri constanta de disociere nu are sens?
În ce cazuri constanta de disociere nu are sens? Concentrația soluțiilor
Concentrația soluțiilor Electroliza soluțiilor: descriere, aplicare
Electroliza soluțiilor: descriere, aplicare Heterogenitate echilibrată
Heterogenitate echilibrată Coeficient izotonic
Coeficient izotonic Care este normalitatea soluției? Cum se determină normalitatea soluției? Formula pentru…
Care este normalitatea soluției? Cum se determină normalitatea soluției? Formula pentru… Soluții adevărate sunt ce? Proprietăți și compoziție
Soluții adevărate sunt ce? Proprietăți și compoziție Solubilitatea este ce?
Solubilitatea este ce? Probleme privind soluțiile și metodele de soluționare a acestora
Probleme privind soluțiile și metodele de soluționare a acestora Tipuri de soluții. Tipuri de concentrație a soluției
Tipuri de soluții. Tipuri de concentrație a soluției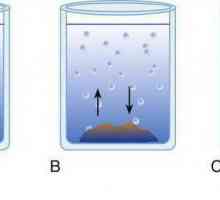 Soluții: concentrație, fracție de masă. Definiție, calcul și recomandări
Soluții: concentrație, fracție de masă. Definiție, calcul și recomandări Structura moleculară are ... Ce substanță are o structură moleculară
Structura moleculară are ... Ce substanță are o structură moleculară Dispozitive de dispersie: caracteristici generale și clasificare
Dispozitive de dispersie: caracteristici generale și clasificare Detergenți sintetici
Detergenți sintetici Soluții tampon: preparare și utilizare
Soluții tampon: preparare și utilizare Particulă coloidală: definiție, caracteristici, tipuri și proprietăți
Particulă coloidală: definiție, caracteristici, tipuri și proprietăți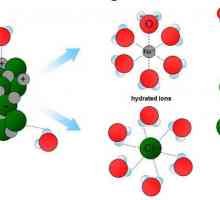 Soluția adevărată: definiție, atribute, compoziție, proprietăți, exemple
Soluția adevărată: definiție, atribute, compoziție, proprietăți, exemple Legea lui Raoul.
Legea lui Raoul. Soluții de electroliți
Soluții de electroliți
 Concentrația de moleculă. Care este concentrația molară și molară?
Concentrația de moleculă. Care este concentrația molară și molară? Care este normalitatea soluției? Cum se determină normalitatea soluției? Formula pentru…
Care este normalitatea soluției? Cum se determină normalitatea soluției? Formula pentru… Soluții adevărate sunt ce? Proprietăți și compoziție
Soluții adevărate sunt ce? Proprietăți și compoziție Solubilitatea este ce?
Solubilitatea este ce? Probleme privind soluțiile și metodele de soluționare a acestora
Probleme privind soluțiile și metodele de soluționare a acestora