Soluții adevărate sunt ce? Proprietăți și compoziție
În natură, aproape că nu apar substanțe pure.
conținut

Caracteristicile soluțiilor reale
Soluțiile adevărate sunt un fel de sisteme de dispersie care au o mare rezistență între mediul de dispersie și faza de dispersie.
Orice produs chimic poate produce cristale de diferite dimensiuni. În orice caz, ele vor avea aceeași structură internă: o latură ionică sau cu cristale moleculare.
dizolvare
În timpul dizolvării boabelor de clorură de sodiu și zahăr în apă, se formează o soluție ionică și moleculară. În funcție de gradul de fragmentare, substanța poate avea forma:
- particule macroscopice vizibile, a căror dimensiune este mai mare de 0,2 mm;
- particulele microscopice având o dimensiune mai mică de 0,2 mm, pot fi capturate numai cu ajutorul unui microscop.
Soluțiile adevărate și coloidale diferă în mărimea particulelor de substanță dizolvată. Cristalele invizibile sunt numite particule coloidale într-un microscop, iar starea rezultată este numită soluție coloidală.

Faza de rezolvare
În multe cazuri, soluțiile adevărate sunt sistemele dezintegrate (dispersate) de formă omogenă. Acestea conțin o fază continuă continuă - mediul de dispersie și particule sfărâmate de o anumită formă și mărime (fază dispersată). Care este diferența dintre soluțiile coloidale și sistemele adevărate?
Principala diferență este în mărime particule. Coloid-dispersat sistemele sunt considerate eterogene, deoarece este imposibil să se detecteze interfața dintre faze într-un microscop luminos.
Soluțiile adevărate sunt opțiunea când în mediu substanța este reprezentată ca ioni sau molecule. Acestea se referă la soluții omogene monofazate.
Ca o condiție prealabilă pentru formarea sistemelor de dispersie, se ia în considerare dizolvarea reciprocă a mediului de dispersie și a substanței dispersabile. De exemplu, clorură de sodiu și zaharoza sunt insolubile în benzen și kerosen, prin urmare, într-un astfel de solvent, soluțiile coloidale nu vor fi formate.

Clasificarea sistemelor de dispersie
Cum sunt împărțite sistemele dispersate? adevărat soluții, coloidale sistemele diferă în mai mulți parametri.
Există o subdiviziune a sistemelor dispersate peste starea agregată a mediului și a fazei dispersate, formarea sau absența interacțiunii dintre ele.
caracteristicile
Există anumite caracteristici cantitative ale dispersiei materiei. În primul rând, gradul de dispersie se distinge. Această valoare este inversă a mărimii particulelor. Caracterizează numărul de particule care pot fi plasate într-un rând la o distanță de un centimetru.
În cazul în care toate particulele au aceleași dimensiuni, se formează un sistem monodispers. Cu particule neidentificate ale fazei dispersate, se formează un sistem polidispers.
Odată cu creșterea dispersiei materiei, procesele care apar în suprafața interfazică cresc în ea. De exemplu, suprafața specifică a fazei dispersate crește, efectele fizico-chimice ale mediului pe interfața dintre cele două faze cresc.

Variante de sisteme de dispersie
În funcție de faza în care va fi localizată substanța dizolvată, sunt izolate diferite variante de sisteme de dispersie.
Aerosolii sunt sisteme dispersate în care un mediu dispersat este reprezentat în formă gazoasă. Mistrele sunt aerosoli care au o fază dispersată în lichid. Fumul și praful formează o fază dispersată solidă.
Spumele sunt o dispersie în lichid a unei substanțe gazoase. Lichidele din spumă degenerate în filme care separă bulele de gaze.
Emulsiile se numesc sisteme de dispersie, în care un lichid este distribuit în volum de altul fără a se dizolva în el.
Suspensiile sau suspensiile sunt sisteme cu dispersie scăzută în care particulele solide sunt într-un lichid. Soluțiile coloidale sau solurile cu un sistem dispersat în apă sunt numite hidrozoli.
În funcție de prezența (absența) între particulele fazei dispersate, sunt izolate sistemele dispersate liber sau coezive dispersate. Primul grup include lizozoli, aerosoli, emulsii, suspensii. În astfel de sisteme nu există contacte între particule și faza de dispersie. Ei sunt liberi să se miște în soluție sub influența gravitației.
Sistemele coerente apar în cazul contactului particulelor cu o fază dispersată, ca urmare a formării structurilor sub forma unei rețele sau a unui cadru. Astfel de sisteme coloidale se numesc geluri.
Procesul de gelificare (gelatinizare) este conversia solului într-un gel bazat pe o scădere a stabilității solului inițial. Exemple de sisteme dispersate coezive sunt suspensii, emulsii, pulberi, spume. Acestea includ și solul format în timpul interacțiunii substanțelor organice (humice) și mineralelor din sol.
Sistemele capilare-dispersate sunt caracterizate de o masă continuă de substanță care penetrează capilarele și porii. Ei consideră țesături, membrane diferite, lemn, carton, hârtie.
Soluțiile reale sunt sisteme omogene constând din două componente. Acestea pot exista în solvenți diferiți în stare agregată. Solventul este considerat o substanță preluată în exces. O componentă care este luată în cantități insuficiente este considerată a fi o substanță dizolvată.

Caracteristicile soluțiilor
Aliajele solide sunt de asemenea soluții în care diferite metale acționează ca medii dispersate și componente. Din punct de vedere practic, un interes deosebit îl au amestecurile lichide în care lichidul acționează ca solvent.
Dintre mulți solvenți anorganici, apa prezintă un interes deosebit. Practic, întotdeauna soluția adevărată este formată atunci când particulele substanței dizolvate sunt amestecate cu apă.
Printre compușii organici, următorii solvenți sunt solvenți excelenți: etanol, metanol, benzen, tetraclorură de carbon, acetonă. Datorită mișcării haotice a moleculelor sau a ionilor componentei dizolvate, are loc o tranziție parțială la soluție, formarea unui nou sistem omogen.
Substanțele diferă în ceea ce privește capacitatea lor de a forma soluții. Unii se pot amesteca între ei în cantități nelimitate. Un exemplu este dizolvarea în apă a cristalelor de sare de masă.
Esența procesului de dizolvare din punctul de vedere al teoriei moleculare-cinetice este că după introducerea în solvent a cristalelor de clorură de sodiu se disociază în cationi de sodiu și anioni de clor. Particulele încărcate vibrează, ciocnirile cu particulele solventului în sine conduc la trecerea ionilor în solvent (legare). Treptat, alte particule sunt conectate la proces, stratul de suprafață este distrus, cristalul de sare se dizolvă în apă. Difuzia face posibilă distribuirea particulelor substanței de-a lungul volumului solventului.

Tipuri de soluții adevărate
O soluție adevărată este un sistem care este împărțit în mai multe tipuri. Există o clasificare a unor astfel de sisteme pentru apă și non-apoase de tipul solventului. Ele sunt, de asemenea, clasificate în funcție de varianta substanței dizolvate pentru alcalii, acizi, săruri.
Există diferite tipuri de soluții reale cu privire la curentul electric: neelectroliți, electroliți. În funcție de concentrația substanței dizolvate, pot fi diluate sau concentrate.
Soluțiile adevărate ale substanțelor moleculare mici din punct de vedere termodinamic sunt împărțite în real și ideal.
Astfel de soluții pot fi dispersate ionic, precum și sisteme de dispersie moleculară.

Saturarea soluțiilor
În funcție de cantitatea de particule care trece în soluție, există soluții saturate suprasaturate, nesaturate. Soluția este un sistem lichid sau solid, omogen, compus din mai multe componente. În orice astfel de sistem, există în mod necesar un solvent, precum și o substanță dizolvată. Odată cu dizolvarea unor substanțe, căldura este eliberată.
Un proces similar confirmă teoria soluțiilor, conform căreia dizolvarea este privită ca un proces fizico-chimic. Există o subdiviziune a procesului de dizolvare în trei grupe. Primul este alcătuit din acele substanțe care sunt capabile să se dizolve într-o cantitate de 10 g pe 100 g de solvent, fiind denumite bine solubile.
Substanțele sunt considerate a fi ușor solubile dacă sunt dizolvate mai puțin de 10 g în 100 g componentă, celelalte fiind numite insolubile.
concluzie
Sistemele constând în stare agregată diferită, dimensiuni ale particulelor, sunt necesare pentru activitatea umană normală. Soluțiile adevărate, coloidale discutate mai sus sunt folosite pentru a face medicamente, pentru a crea produse alimentare. Având o idee despre concentrația substanței dizolvate, puteți să vă pregătiți în mod independent soluția necesară, de exemplu, alcoolul etilic sau acidul acetic, pentru diferite scopuri în viața de zi cu zi. În funcție de starea în care substanța solubilă și solventul sunt în stare agregată, sistemele rezultate au anumite caracteristici fizice și chimice.
 Miscarea lui Brown: informatii generale.
Miscarea lui Brown: informatii generale. Proprietăți ale electroliților. Electroliți puternici și slabi. Electroliți - ce este?
Proprietăți ale electroliților. Electroliți puternici și slabi. Electroliți - ce este? Concentrația de moleculă. Care este concentrația molară și molară?
Concentrația de moleculă. Care este concentrația molară și molară? Heterogenitate echilibrată
Heterogenitate echilibrată Tipuri de soluții. Tipuri de concentrație a soluției
Tipuri de soluții. Tipuri de concentrație a soluției Soluții: concentrație, fracție de masă. Definiție, calcul și recomandări
Soluții: concentrație, fracție de masă. Definiție, calcul și recomandări Structura moleculară are ... Ce substanță are o structură moleculară
Structura moleculară are ... Ce substanță are o structură moleculară Tipuri de laturi cristaline de diferite substanțe
Tipuri de laturi cristaline de diferite substanțe Ce este coagularea? Prag de coagulare. Reguli de coagulare electrolitică
Ce este coagularea? Prag de coagulare. Reguli de coagulare electrolitică Solubilitatea substanțelor: tabel. Solubilitatea substanțelor în apă
Solubilitatea substanțelor: tabel. Solubilitatea substanțelor în apă Faza dispersată este ceea ce?
Faza dispersată este ceea ce? Cristale lichide
Cristale lichide Dispozitive de dispersie: caracteristici generale și clasificare
Dispozitive de dispersie: caracteristici generale și clasificare Fizica moleculară
Fizica moleculară Cristal ionic
Cristal ionic Factorii care afectează rata de reacție chimică
Factorii care afectează rata de reacție chimică Particulă coloidală: definiție, caracteristici, tipuri și proprietăți
Particulă coloidală: definiție, caracteristici, tipuri și proprietăți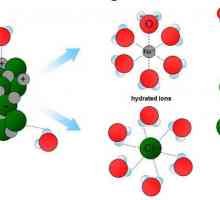 Soluția adevărată: definiție, atribute, compoziție, proprietăți, exemple
Soluția adevărată: definiție, atribute, compoziție, proprietăți, exemple Soluții coloidale - un cuvânt nou în medicină
Soluții coloidale - un cuvânt nou în medicină Ce este o legătură ionică? Exemple de substanțe cu acesta și proprietățile sale
Ce este o legătură ionică? Exemple de substanțe cu acesta și proprietățile sale Care sunt proprietățile columbative ale soluțiilor?
Care sunt proprietățile columbative ale soluțiilor?
 Proprietăți ale electroliților. Electroliți puternici și slabi. Electroliți - ce este?
Proprietăți ale electroliților. Electroliți puternici și slabi. Electroliți - ce este? Concentrația de moleculă. Care este concentrația molară și molară?
Concentrația de moleculă. Care este concentrația molară și molară? Tipuri de soluții. Tipuri de concentrație a soluției
Tipuri de soluții. Tipuri de concentrație a soluției Soluții: concentrație, fracție de masă. Definiție, calcul și recomandări
Soluții: concentrație, fracție de masă. Definiție, calcul și recomandări Structura moleculară are ... Ce substanță are o structură moleculară
Structura moleculară are ... Ce substanță are o structură moleculară Ce este coagularea? Prag de coagulare. Reguli de coagulare electrolitică
Ce este coagularea? Prag de coagulare. Reguli de coagulare electrolitică Solubilitatea substanțelor: tabel. Solubilitatea substanțelor în apă
Solubilitatea substanțelor: tabel. Solubilitatea substanțelor în apă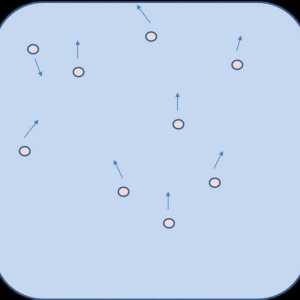 Faza dispersată este ceea ce?
Faza dispersată este ceea ce?