Proprietăți chimice și fizice ale fierului
Fierul este un element chimic binecunoscut. Se referă la media pentru activitatea chimică a metalelor. Proprietățile și aplicațiile fierului sunt discutate în acest articol.
conținut
- Prevalența în natură
- Fier: proprietăți fizice și chimice
- Proprietățile fizice ale fierului
- Din punctul de vedere al chimiei
- Să începem cu simplu
- Ferrum și substanțe complexe
- Cu acizi și săruri
- Importanța pentru organism
- Produse bogate în fier
- Semne ale deficienței în corpul fierului
- Utilizarea ferulului în industrie
- Pregătirea fierului
- Concluzie
Prevalența în natură
Există o cantitate destul de mare de minerale, care includ ferrum. Mai întâi de toate, este magnetit. Este un fier de șaptezeci și doi la sută. Formula sa chimică este Fe3O4. Acest mineral este denumit și minereu de fier magnetic. Are o culoare gri deschis, uneori cu un gri închis, până la negru, cu un luciu metalic. Cel mai mare depozit în rândul țărilor CSI se află în Ural.

Următorul mineral cu conținut ridicat de fier este hematit - este de șaptezeci la sută din acest element. Formula sa chimică este Fe2O3. Se mai numește și minereu de fier roșu. Are o culoare de la roșu-brun la roșu-gri. Cel mai mare domeniu din CSI este în Krivoy Rog.
Al treilea mineral în conținutul de ferrum este limonitul. Aici fierul este șaizeci la sută din masa totală. Acesta este un hidrat de cristal, adică moleculele de apă sunt interconectate în rețeaua de cristal, formula chimică a acestuia fiind Fe2O3• H2O. După cum puteți vedea din denumire, acest mineral are o culoare galben-maronie, ocazional maro. Este una dintre principalele componente ale ocrului natural și este utilizată ca pigment. Se mai numește și minereu de fier brun. Cele mai mari locuri sunt Crimeea, Uralii.
În siderit, așa-numitul minereu de fier, patruzeci și opt la sută din ferrum. Formula sa chimică este FeCO3. Structura sa este eterogenă și constă din cristale de diferite culori îmbinate: gri, verde pal, gri-galben, maro-galben etc.
Acesta din urmă este un mineral natural cu un conținut ridicat de pirumiți, pirită. Are o astfel de formulă chimică FeS2. Fierul în el este patruzeci și șase la sută din masa totală. Datorită atomilor de sulf, acest mineral are o culoare galben auriu.
Multe din mineralele considerate sunt folosite pentru a produce fierul pur. În plus, hematitul este utilizat în fabricarea bijuteriilor din pietre naturale. Includerea de pirită poate fi găsită în podoabe din lapis lazuli. În plus, în natură, fierul se găsește în organismele vii - este una dintre cele mai importante componente ale celulei. Acest microelement trebuie să intre în corpul uman în cantități suficiente. Proprietățile de vindecare ale fierului se datorează în mare măsură faptului că acest element chimic este baza hemoglobinei. Prin urmare, utilizarea ferului afectează bine starea sângelui și, în consecință, a întregului organism ca întreg.
Fier: proprietăți fizice și chimice
Luați în considerare, în ordine, două dintre aceste secțiuni mari. Proprietăți fizice fier - acesta este aspectul, densitatea, punctul de topire etc. Aceasta înseamnă toate trăsăturile distinctive ale materiei care sunt legate de fizică. Proprietățile chimice ale fierului sunt capacitatea de a reacționa cu alți compuși. Să începem cu prima.
Proprietățile fizice ale fierului
În forma sa pură, în condiții normale, este o substanță solidă. Are o culoare gri-argintiu și un luciu metalic pronunțat. Proprietățile mecanice ale fierului includ nivelul de duritate Mohs. Ea este egală cu patru (medie). Fierul are o bună conductivitate electrică și conductivitate termică. Ultima caracteristică poate fi simțită prin atingerea unui obiect de fier într-o cameră rece. Din moment ce acest material conduce rapid căldură, aceasta ia o mare parte din ea din piele într-un timp scurt, și, prin urmare, vă simțiți rece.  Atingând, de exemplu, unui copac, se poate observa că conductivitatea termică este mult mai scăzută. Proprietățile fizice ale fierului sunt, de asemenea, punctele sale de topire și de fierbere. Primul este 1539 grade Celsius, al doilea - 2860 grade Celsius. Se poate concluziona că proprietățile caracteristice ale fierului - o bună plasticitate și fuzibilitate. Dar chiar și asta nu este totul.
Atingând, de exemplu, unui copac, se poate observa că conductivitatea termică este mult mai scăzută. Proprietățile fizice ale fierului sunt, de asemenea, punctele sale de topire și de fierbere. Primul este 1539 grade Celsius, al doilea - 2860 grade Celsius. Se poate concluziona că proprietățile caracteristice ale fierului - o bună plasticitate și fuzibilitate. Dar chiar și asta nu este totul.
De asemenea, în proprietățile fizice ale fierului este ferromagnetismul său. Ce este? Fierul, ale cărui proprietăți magnetice pe care le putem observa pe exemple practice în fiecare zi, este singurul metal care posedă o astfel de caracteristică distinctivă unică. Acest lucru se datorează faptului că acest material este capabil să magnetizeze sub acțiunea unui câmp magnetic. Și după terminarea ultimului fier, proprietățile magnetice care tocmai s-au format, rămâne el însuși un magnet pentru o lungă perioadă de timp. Un astfel de fenomen poate fi explicat prin faptul că în structura unui metal dat există mulți electroni liberi care se pot mișca.
Din punctul de vedere al chimiei
Acest element se referă la metale cu activitate medie. Dar proprietățile chimice ale fierului sunt tipice pentru toate celelalte metale (cu excepția celor care sunt în dreapta hidrogenului din seria electrochimică). Este capabil să reacționeze cu multe clase de substanțe.
Să începem cu simplu
Ferrum interacționează cu un kilogram, azot, halogeni (iod, brom, clor, fluor), fosfor, carbon. Primul lucru de luat în considerare este reacția cu oxigenul. Atunci când ferumul este ars, se formează oxizi. În funcție de condițiile de reacție și de proporțiile dintre cei doi participanți, ele pot fi diverse. Ca un exemplu al acestui tip de interacțiune, se pot cita următoarele ecuații de reacție: 2Fe + O2 = 2FeO-4Fe + 302 = 2Fe2O3- 3Fe + 2 O2 = Fe3O4. Iar proprietățile oxidului de fier (fizic și chimic) pot fi variate, în funcție de varietatea sa. Astfel de reacții apar la temperaturi ridicate.

Următoarea este interacțiunea cu azotul. De asemenea, poate apărea numai cu condiția încălzirii. Dacă luăm șase moli de fier și un mol de azot, obținem două moli de nitruri de fier. Ecuația de reacție va arăta astfel: 6Fe + N2 = 2Fe3N.
Atunci când interacționează cu fosfor, se formează o fosfură. Pentru a efectua reacția, sunt necesare astfel de componente: trei moli de ferulă - un mol de fosfor, rezultând formarea unui mol de fosfură. Ecuația poate fi scrisă după cum urmează: 3Fe + P = Fe3P.
În plus, printre reacțiile cu substanțe simple, este posibilă separarea interacțiunii cu sulful. În acest caz, este posibil să se obțină o sulfură. Principiul prin care are loc procesul de formare a acestei substanțe este similar cu cel descris mai sus. Anume, reacția de adiție are loc. Pentru toate interacțiunile chimice de acest tip, sunt necesare condiții speciale, în special temperaturi ridicate și, mai puțin, catalizatori.
De asemenea, în industria chimică sunt frecvente reacțiile dintre fier și halogeni. Aceasta este clorurarea, bromurarea, iodarea, fluorurarea. Ca nume în sine reacții, un proces de aderare la Ferrum atomi atomi de clor / brom / iod / fluorură pentru a forma clorură / bromură / iodură / fluorură respectiv. Aceste substanțe sunt utilizate pe scară largă într-o varietate de industrii. În plus, ferumul este capabil să se combine cu siliciu la temperaturi ridicate. Datorită faptului că proprietățile chimice ale fierului sunt diverse, acesta este adesea folosit în industria chimică.
Ferrum și substanțe complexe
Din substanțe simple, procedăm la aceia ale căror molecule constau din două sau mai multe elemente chimice diferite. Primul lucru de menționat este reacția ferului cu apă. Aici se manifestă proprietățile de bază ale fierului. Atunci când apa este încălzită împreună cu fierul, oxid de bază (se numește așa deoarece reacționează cu aceeași apă pentru a forma hidroxid, cu alte cuvinte - baza). Deci, dacă luăm un mol de componente sunt formate de substanțe, cum ar fi dioxidul de hidrogen gazos și ferrum cu un miros înțepător - ca și în raport molar de unu la unu. Ecuația acestui tip de reacție poate fi scrisă după cum urmează: Fe + H2O = FeO + H2. În funcție de proporțiile în care se amestecă aceste două componente, pot fi obținute di- sau trioxid de fier. Ambele substanțe sunt foarte frecvente în industria chimică și sunt utilizate și în multe alte industrii.
Cu acizi și săruri
Deoarece ferumul este situat în partea stângă a hidrogenului în seria electrochimică a activității metalice, acesta poate deplasa acest element din compuși. Un exemplu este reacția de substituție, care poate fi observată atunci când fierul este adăugat la acid. De exemplu, dacă este amestecat în proporții molare egale de fier și acid sulfat (aka sulfuric) concentrația medie, ca rezultat obținem sulfat de fier (II) și hidrogen în proporții molare egale. Ecuația pentru o astfel de reacție ar arăta astfel: Fe + H2SO4 = FeSO4 + H2.
În interacțiunea cu sărurile, se manifestă proprietățile reducătoare ale fierului. Aceasta este, folosind, puteți selecta un metal mai puțin activ din sare. De exemplu, dacă luați o molelă sulfat de cupru și poate fi obținută aceeași cantitate de ferum, sulfat de fier (II) și cupru pur în aceleași proporții molare.
Importanța pentru organism
Unul dintre cele mai comune elemente chimice din scoarța pământului este fierul. Proprietățile substanței am considerat deja, acum venim la el din punct de vedere biologic. Ferrum îndeplinește funcții foarte importante atât la nivel celular, cât și la nivelul întregului organism. Mai întâi de toate, fierul este baza unei proteine cum ar fi hemoglobina. Este necesar pentru transportul oxigenului prin sânge din plămâni la toate țesuturile, organele, la fiecare celulă a corpului, în primul rând la neuronii creierului. Prin urmare, proprietățile utile ale fierului nu pot fi supraevaluate.

Pe lângă faptul că afectează formarea sângelui, ferumul este, de asemenea, important pentru buna funcționare a tiroidei (pentru aceasta nu este necesar doar iod, așa cum cred unii). De asemenea, fierul participă la metabolismul intracelular, reglează imunitatea. Totuși ferrumul într-o cantitate deosebit de mare este conținut în celulele hepatice, deoarece ajută la neutralizarea substanțelor nocive. Este, de asemenea, una dintre principalele componente ale multor tipuri de enzime din corpul nostru. Dieta zilnică a unei persoane ar trebui să conțină între zece și douăzeci de miligrame din acest oligoelement.
Produse bogate în fier
Sunt multe astfel. Sunt legume și animale. În primul rând - aceasta este cereale, leguminoase, cereale (in special hrisca), mere, ciuperci (alb), fructe uscate, măceșe, pere, piersici, avocado, dovleac, migdale, smochine, roșii, broccoli, varză, afine, mure, țelină, etc. Al doilea - ficatul, carnea. Utilizarea unui produs conținut ridicat de fier este deosebit de important în timpul sarcinii, deoarece corpul fătului format necesită o cantitate mare de micronutrient pentru creșterea și dezvoltarea corespunzătoare.
Semne ale deficienței în corpul fierului
Simptomele de prea puțin cantitatea de Ferrum care intră în organism sunt oboseala, mâini congelare constante și picioare, depresie, parul si unghiile fragile, reducerea activității intelectuale, tulburări digestive, performanță scăzută, funcționarea defectuoasă a glandei tiroide. Dacă observați unele dintre aceste simptome, este necesar să se mărească numărul de produse care conțin fier în dieta dumneavoastră sau pentru a cumpăra vitamine sau suplimente care contin Ferrum. De asemenea, asigurați-vă că să se consulte medicul dumneavoastră dacă oricare dintre aceste simptome vă simțiți prea rău.
Utilizarea ferulului în industrie
Aplicarea și proprietățile fierului sunt strâns legate. Datorita feromagnetic sale, este utilizat pentru fabricarea de magneți - atât mai slab pentru uz casnic (magneți de suveniruri de pe frigider, etc ...) Și mai puternic - în scopuri industriale. Datorită faptului că metalul considerat are o rezistență ridicată și duritate, cu vechimea sa folosit pentru arme, armuri, și alte instrumente militare și interne. Apropo, în Egiptul antic a fost cunoscut de fier meteoritic cu proprietăți superioare celor ale unui metal convențional. De asemenea, a fost folosit un astfel de fier special și în Roma antică. Din el au făcut arme de elită. Scut sau o sabie din metal meteorica, ar putea avea doar un om foarte bogat și distins.

În general, metalul pe care îl considerăm în acest articol este cel mai versatil utilizat între toate substanțele din acest grup. În primul rând, produce oțel și fontă, care sunt utilizate pentru a produce toate tipurile de produse necesare în industrie și în viața de zi cu zi.
Fonta este un aliaj de fier și carbon, în care al doilea este prezent de la 1,7 la 4,5 procente. Dacă al doilea este mai mic de 1,7%, atunci acest tip de aliaj se numește oțel. Dacă carbonul din compoziție este prezent de circa 0,02%, atunci acesta este deja fierul tehnic obișnuit. Prezența carbonului în aliaj este necesară pentru a conferi o rezistență mai mare, stabilitate termică, rezistență la rugină.
În plus, oțelul poate conține multe alte elemente chimice ca impurități. Acestea sunt mangan, fosfor și siliciu. De asemenea, în acest tip de aliaj pentru a conferi anumite calități pot fi adăugate crom, nichel, molibden, tungsten, și multe alte elemente chimice. Tipuri de oțel, în care o cantitate mare de dioxid de siliciu prezent (circa patru la suta), folosite ca un transformator. Cei din componența pe care o mulțime de mangan (până la doisprezece sau paisprezece la suta), își găsesc aplicare în fabricarea de piese de căi ferate, mori, polizoare și alte instrumente, părți care sunt supuse la abraziune rapidă.
Molibdenul este injectat în aliaj pentru al face mai stabil din punct de vedere termic - astfel de oțeluri sunt folosite ca instrumentale. În plus, pentru a obține toate cele cunoscute și adesea folosite în casă sub formă de cuțite și alte unelte de uz casnic din oțeluri inoxidabile, este necesar să adăugați crom, nichel și titan la aliaj. Și pentru a obține oțel ductil rezistent la șocuri, de înaltă rezistență, este suficient să adăugați vanadiu la acesta. Odată cu introducerea niobiului, este posibilă obținerea unei rezistențe ridicate la coroziune și a acțiunii substanțelor chimice agresive.
Mineritul magnetit, menționat la începutul articolului, este necesar pentru producerea de discuri dure, carduri de memorie și alte dispozitive de acest tip. Datorită proprietăților magnetice, fierul poate fi găsit în dispozitivul transformatoarelor, motoarelor, produselor electronice etc. În plus, ferumul poate fi adăugat la aliajele altor metale pentru a le conferi o rezistență mai mare și o stabilitate mecanică. Sulfatul acestui element este utilizat în horticultură pentru combaterea dăunătorilor (împreună cu sulfatul de cupru). Clorurile de fier sunt indispensabile pentru purificarea apei. În plus, praful de magnetit este utilizat în imprimantele alb-negru. Principala modalitate de utilizare a piritului este scoaterea acidului sulfuric din acesta. Acest proces are loc în laborator în trei etape. În prima etapă de pirită, ferumul este ars, obținându-se astfel oxid de fier și dioxid de sulf. În a doua etapă, conversia dioxidului de sulf în trioxidul său are loc cu participarea oxigenului. Și în stadiul final, substanța obținută este trecută vapori de apă în prezența catalizatorilor, obținându-se astfel acid sulfuric.
Clorurile de fier sunt indispensabile pentru purificarea apei. În plus, praful de magnetit este utilizat în imprimantele alb-negru. Principala modalitate de utilizare a piritului este scoaterea acidului sulfuric din acesta. Acest proces are loc în laborator în trei etape. În prima etapă de pirită, ferumul este ars, obținându-se astfel oxid de fier și dioxid de sulf. În a doua etapă, conversia dioxidului de sulf în trioxidul său are loc cu participarea oxigenului. Și în stadiul final, substanța obținută este trecută vapori de apă în prezența catalizatorilor, obținându-se astfel acid sulfuric.
Pregătirea fierului
În general, acest metal este extras din cele două minerale principale: magnetit și hematit. Acest lucru se face prin reducerea fierului din compușii săi prin carbon sub formă de cocs. Acest lucru se face în furnale, temperatura în care atinge două mii de grade pe o scară de Celsius. În plus, există o modalitate de a restabili hidrogenul de ferrum. Pentru aceasta, nu este necesar un cuptor. Pentru a pune în aplicare această metodă, luați o argilă specială, amestecați-o cu minereu zdrobit și procesați-o cu hidrogen într-un cuptor cu arbore.
concluzie
Proprietățile și aplicațiile fierului sunt diverse. Acesta este probabil cel mai important metal din viata noastra. După ce a cunoscut omenirea, el a luat locul bronzului, care la acel moment era principalul material pentru fabricarea tuturor uneltelor, precum și a armelor. Oțelul și fonta, în multe privințe, depășesc aliajul de cupru cu staniu în ceea ce privește proprietățile sale fizice, rezistența la influențele mecanice.
În plus, fierul de pe planeta noastră este mai obișnuit decât multe alte metale. Fracțiune de masă este aproape cinci procente în scoarța pământului. Acesta este al patrulea element chimic cel mai comun în natură. De asemenea, acest element chimic este foarte important pentru funcționarea normală a organismului de animale și plante, în primul rând pentru că se bazează pe hemoglobină. Fierul este un microelement important, a cărui utilizare este importantă pentru menținerea sănătății și funcționarea normală a organelor. În plus față de cele de mai sus, acesta este singurul metal care are proprietăți magnetice unice. Fără un ferrum este imposibil să ne imaginăm viața.
 Pregătirea fierului "Ferrum lek". Instrucțiuni de utilizare.
Pregătirea fierului "Ferrum lek". Instrucțiuni de utilizare. Preparate din fier.
Preparate din fier. Ciclul de fier în natură. Bacterii de fier. Extracția și aplicarea fierului
Ciclul de fier în natură. Bacterii de fier. Extracția și aplicarea fierului Pyrite (fierite de fier): proprietăți fizice și magice. Aplicarea mineralelor în industrie
Pyrite (fierite de fier): proprietăți fizice și magice. Aplicarea mineralelor în industrie Resursele minerale ale Uralilor - descriere și caracteristici
Resursele minerale ale Uralilor - descriere și caracteristici Cum se curata fierul din carbon: modalitati eficiente de top
Cum se curata fierul din carbon: modalitati eficiente de top Ce este pulberea de talc? Totul despre mineralul uimitor
Ce este pulberea de talc? Totul despre mineralul uimitor Pirații sunt concediați în multe țări
Pirații sunt concediați în multe țări Anemia: conținutul ridicat de fier în alimente va ajuta la rezolvarea problemei
Anemia: conținutul ridicat de fier în alimente va ajuta la rezolvarea problemei Compuși ai fierului. Fier: proprietăți fizice și chimice
Compuși ai fierului. Fier: proprietăți fizice și chimice Hidroxid feric 3
Hidroxid feric 3 Punctul de topire al fierului
Punctul de topire al fierului Clorura ferică
Clorura ferică Unde sunt depozitele de minereu de fier din Rusia?
Unde sunt depozitele de minereu de fier din Rusia? Ce este minereul? Depozitul de minereuri de fier. Minereuri ale Rusiei
Ce este minereul? Depozitul de minereuri de fier. Minereuri ale Rusiei Anemia de deficit de fier și medicamentul "Ferrum lek".
Anemia de deficit de fier și medicamentul "Ferrum lek". Pirita de cupru: aplicare și proprietăți
Pirita de cupru: aplicare și proprietăți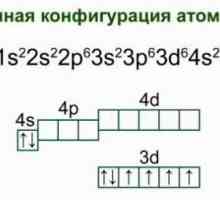 Fier: structura atomului, schema și exemple. Structura electronică a atomului de fier
Fier: structura atomului, schema și exemple. Structura electronică a atomului de fier Valence de fier. Care este valența fierului?
Valence de fier. Care este valența fierului? Sferale mineral: fotografie, proprietăți, origine, formulă
Sferale mineral: fotografie, proprietăți, origine, formulă Fier, densitatea fierului, proprietățile sale
Fier, densitatea fierului, proprietățile sale
 Ciclul de fier în natură. Bacterii de fier. Extracția și aplicarea fierului
Ciclul de fier în natură. Bacterii de fier. Extracția și aplicarea fierului Pyrite (fierite de fier): proprietăți fizice și magice. Aplicarea mineralelor în industrie
Pyrite (fierite de fier): proprietăți fizice și magice. Aplicarea mineralelor în industrie Cum se curata fierul din carbon: modalitati eficiente de top
Cum se curata fierul din carbon: modalitati eficiente de top Ce este pulberea de talc? Totul despre mineralul uimitor
Ce este pulberea de talc? Totul despre mineralul uimitor Pirații sunt concediați în multe țări
Pirații sunt concediați în multe țări Compuși ai fierului. Fier: proprietăți fizice și chimice
Compuși ai fierului. Fier: proprietăți fizice și chimice