Compuși ai fierului. Fier: proprietăți fizice și chimice
Primele produse de fier și aliajele sale au fost găsite în timpul săpăturilor și datează din jurul mileniului 4 î.Hr. Asta este, chiar și vechii egipteni și sumerienii au folosit depozitele de meteorit ale acestei substanțe pentru a face bijuterii și articole de uz casnic, precum și arme.
conținut

Astăzi, compușii de fier de diferite tipuri, precum și metalele pure, sunt substanțele cele mai comune și utilizate. Nu e de mirare că secolul al XX-lea a fost considerat fier. La urma urmei, înainte de apariția și distribuția largă a materialelor plastice și a altor materiale conexe, această legătură a avut o importanță decisivă pentru om. Ce este acest element și ce substanțe se formează, vom lua în considerare în acest articol.
Elementul chimic al fierului
Dacă luăm în considerare structura unui atom, trebuie mai întâi să indicăm locațiile sale în tabelul periodic.
- Numărul de serie este 26.
- Perioada este a patra mare.
- Grupul este al optulea, subgrupul este secundar.
- Greutatea atomică este de 55.847.
- Structura carcasei de electroni exterioare este notată cu formula 3d64s2.
- Simbolul elementului chimic este Fe.
- Numele este fier, citirea în formula este ferrum.
- În natură, există patru izotopi stabili ai elementului examinat cu numerele de masă 54, 56, 57, 58.
Elementul chimic al fierului are de asemenea aproximativ 20 de izotopi diferiți care nu se disting prin stabilitate. Posibilele stări de oxidare ale unui atom dat pot prezenta:
- 0;
- +2;
- +3;
- +6.
Important nu este numai elementul în sine, ci și diferiții compuși și aliaje.
Proprietăți fizice
Ca o substanță simplă, fier proprietățile fizice are un metallism pronunțat. Acesta este un alb argintiu, cu o nuanta gri de metal, care are un grad ridicat de ductilitate si plasticitate si un punct de fierbere si topire ridicat. Dacă luăm în considerare caracteristicile în detaliu, atunci:
- punctul de topire 1539 0C;
- punctul de fierbere - 2862 0C;
- activitate - medie;
- mare refractare;
- prezintă proprietăți magnetice pronunțate.
În funcție de condițiile și temperaturile diferite, există mai multe modificări care alcătuiesc fierul. Proprietățile lor fizice diferă de faptul că laturile cristaline diferă.
- Forma alfa, sau ferita, există până la o temperatură de 769 0S.
- De la 769 la 917 0Formular C - beta.
- 917-1394 0C este forma gama sau austenita.
- Mai mult de 1394 0C este fierul sigma.

Toate modificările au diferite tipuri de structuri cu cristale cristaline și diferă de asemenea în proprietățile magnetice.
Proprietăți chimice
După cum sa menționat deja mai sus, o substanță simplă, fierul prezintă o activitate chimică medie. Totuși, într-o stare fin dispersată, este capabilă să se auto-aprindă în aer și în oxigen pur, metalul însuși arde.
Corozivitatea este ridicată, astfel încât aliajele acestei substanțe sunt acoperite cu compuși doping. Fierul este capabil să interacționeze cu:
- acizi;
- oxigen (inclusiv aer);
- sulf;
- halogeni;
- când este încălzit - cu azot, fosfor, carbon și siliciu;
- cu săruri ale metalelor mai puțin active, restabilind-le la substanțe simple;
- cu vapori de apă ascuțiți;
- cu săruri de fier în stare de oxidare +3.
Evident, în manifestarea unei astfel de activități, metalul este capabil să formeze diferiți compuși, diferiți și polari în proprietăți. Asta se întâmplă. Fierul și compușii săi sunt extrem de diversi și se găsesc în cele mai diverse ramuri ale științei, tehnologiei și activității industriale a omului.
Distribuția în natură
Compușii naturali de fier apar destul de des, deoarece acesta este al doilea element cel mai comun pe planeta noastră după aluminiu. În acest metal pur este extrem de rar, în compoziția meteoriților, care vorbește despre spațiile sale mari în spațiu. Masa principală este conținută în compoziția minereurilor, pietrelor și mineralelor.

Dacă vorbim despre conținutul procentual al elementului în cauză în natură, se pot menționa următoarele cifre.
- Miezul planetelor terestre este de 90%.
- În crusta pământului, 5%.
- În mantaua Pământului - 12%.
- În miezul Pământului - 86%.
- În apele râului - 2 mg / l.
- În mare și ocean - 0,02 mg / l.
Cele mai des întâlnite compuși ai fierului formează următoarele minerale:
- magnetit;
- limonită sau minereu de fier brun;
- vivianit;
- pirhotita;
- pirită;
- siderit;
- marcasit;
- loellingite;
- mispikel;
- milanterite și altele.
E încă departe nu este completă listă, deoarece sunt într-adevăr foarte multe. În plus, diferite aliaje create de om sunt larg distribuite. Acestea sunt și acești compuși ai fierului, fără de care este dificil să ne imaginăm viața modernă a oamenilor. Există două tipuri principale:
- fonte turnate;
- oțel.
De asemenea, fierul este un aditiv valoros în compoziția multor aliaje de nichel.
Compușii de fier (II)
Acestea includ pe acelea în care starea de oxidare a elementului de formare este +2. Ele sunt destul de numeroase, deoarece includ:
- oxid;
- hidroxid;
- conexiuni binare;
- săruri complexe;
- compuși complexi.
Formulele de compuși chimici în care fierul prezintă acest grad de oxidare sunt individuali pentru fiecare clasă. Luați în considerare cele mai importante și cele mai comune.
- Oxid de fier (II). Pulberea este negru, nu se dizolvă în apă. Natura conexiunii este esențială. Este capabil să se oxideze rapid, cu toate acestea, poate fi ușor de restaurat la o substanță simplă. Se dizolvă în acizi, formând sărurile corespunzătoare. Formula este FeO.
- Hidroxidul feric (II). Este un precipitat amorf alb. Se formează prin reacția sărurilor cu baze (baze). Ea prezintă proprietăți slabe de bază, este capabilă să oxidizeze rapid în aer compușii de fier +3. Formula este Fe (OH)2.
- Sărurile elementului în starea de oxidare indicată. De obicei, acestea au o culoare verde palidă a soluției, se oxidează bine chiar și în aer, culoarea maro închisă și trecerea în săruri de fier 3. Se dizolvă în apă. Exemple de compuși: FeCL2, FeSO4, Fe (NO3)2.

Valoarea practică între substanțele indicate are mai mulți compuși. În primul rând, clorura de fer (II). Acesta este principalul furnizor de ioni pentru organismul uman, pacient anemic. Atunci când o astfel de afecțiune este diagnosticată la un pacient, atunci sunt prescrise preparate complexe bazate pe compusul în cauză. Acesta este modul în care deficitul de fier este refăcut în organism.
În al doilea rând, fier vitriol, care este sulfatul feros (II), împreună cu cuprul sunt folosite pentru distrugerea dăunătorilor agricoli din culturi. Metoda demonstrează eficacitatea sa nu în primii zece ani, fiind, prin urmare, foarte apreciată de grădinari și de fermierii de camioane.
Sarea Mora
Acest compus, care este hidratul de cristal de sulfat feros și amoniu. Formula sa este scrisă ca FeSO4* (NH4)2SO4* 6H2O. Unul dintre compușii de fier (II), care a fost utilizat pe scară largă în practică. Principalele domenii ale utilizării umane sunt următoarele.
- Farmaceutică.
- Cercetări științifice și analize de titrare laboratorice (pentru determinarea conținutului de crom, permanganat de potasiu, vanadiu).
- Medicina - ca aditiv la alimente cu lipsa de fier în corpul pacientului.
- Pentru impregnarea produselor din lemn, deoarece sarea lui Mohr protejează împotriva proceselor de dezintegrare.
Există și alte domenii în care această substanță găsește o aplicație. Numele pe care la primit în onoarea unui chimist german care a descoperit pentru prima dată proprietățile manifestate.
Substanțe cu un grad de oxidare a fierului (III)
Proprietățile compușilor de fier în care prezintă grade de oxidare +3 sunt oarecum diferite de cele considerate mai sus. Astfel, natura oxidului și a hidroxidului corespunzător nu mai este de bază, ci este pronunțată amfoterică. Să descriem principalele substanțe.
- Oxid de fier (III). Pudra este de culoare cristalină mică, roșu-maroniu. Nu se dizolvă în apă, are proprietăți slab acide, mai amfoterice. Formula: Fe2O3.
- Hidroxidul feric (III). O substanță precipitată prin acțiunea alcalinilor pe sărurile corespunzătoare de fier. Caracterul său este pronunțat amfoteric, culoarea este maro-maroniu. Formula: Fe (OH)3.
- Sare, care includ cationul Fe3+. Un astfel de set se distinge, cu excepția carbonatului, deoarece are loc hidroliza și se eliberează dioxid de carbon. Exemple de formule pentru unele săruri: Fe (NO3)3, Fe2(SO4)3, FeCh3 febr3 și altele.

Printre exemplele date, din punct de vedere practic, un astfel de hidrat cristalin ca FeCL3 *6H2O sau hexahidroclorură de fier (III). Se folosește în medicină pentru a opri sângerarea și a umple ionii de fier în organism cu anemie.
Sulfatul feric nou-fier (III) este utilizat pentru purificarea apei potabile, deoarece se comportă ca un coagulant.
Compușii fierului (VI)
Formulele de compuși chimici ai fierului, în care prezintă un grad special de oxidare +6, pot fi scrise după cum urmează:
- K2FeO4;
- na2FeO4;
- MgFeO4 și altele.
Toți au un nume comun - ferata - și au proprietăți similare (agenți reducători puternici). Ele sunt, de asemenea, capabile să dezinfecteze și să aibă un efect bactericid. Acest lucru le permite să fie utilizate pentru tratarea apei potabile la scară industrială.
Conexiuni complexe
Foarte importante în chimia analitică și nu numai substanțe speciale. Astfel, se formează în soluții apoase de săruri. Acestea sunt compuși complexi de fier. Cele mai populare și bine studiate sunt după cum urmează.
- Hexacianoferrat de potasiu (II) K4[Fe (CN)6]. Un alt nume pentru compus este sarea de sânge galben. Se folosește pentru determinarea calitativă a fierului Fe în soluție3+. Ca urmare a acțiunii, soluția capătă o frumoasă culoare albastră strălucitoare, pe măsură ce se formează un alt complex - Berlin Azure KFe3+[Fe2+(CN)6]. De atunci a fost folosită colorant pentru țesături.
- Hexacianoferrat de potasiu (III) K3[Fe (CN)6]. Un alt nume este sarea de sânge roșu. Utilizat ca reactiv calitativ pentru determinarea ionului de fier Fe2+. Ca rezultat, se formează un precipitat albastru, numit turbo albastru. De asemenea, folosit ca colorant pentru țesături.

Fierul în compoziția substanțelor organice
Fierul și compușii săi, așa cum am văzut deja, au o mare importanță practică în viața economică a omului. Cu toate acestea, în plus, rolul său biologic în organism nu este mai puțin mare, chiar și dimpotrivă.
Există unul foarte important compus organic, proteine, care include acest element. Acesta este hemoglobina. Datorită lui, oxigenul este transportat și se efectuează un schimb uniform de gaze. Prin urmare, rolul fierului în procesul vital de respirație este pur și simplu enorm.

În total, aproximativ 4 grame de fier sunt conținute în corpul uman, care trebuie să fie în mod constant alimentat de consumul de alimente.
 Ciclul de fier în natură. Bacterii de fier. Extracția și aplicarea fierului
Ciclul de fier în natură. Bacterii de fier. Extracția și aplicarea fierului Pyrite (fierite de fier): proprietăți fizice și magice. Aplicarea mineralelor în industrie
Pyrite (fierite de fier): proprietăți fizice și magice. Aplicarea mineralelor în industrie Care este valența sulfului? Posibile valențe de sulf
Care este valența sulfului? Posibile valențe de sulf Metode de obținere a metalelor. Tipuri de aliaje. Producția de metale alcaline
Metode de obținere a metalelor. Tipuri de aliaje. Producția de metale alcaline Este cuprul un corp sau o substanță? Proprietățile cuprului
Este cuprul un corp sau o substanță? Proprietățile cuprului Elementul chimic este staniu. Proprietățile și aplicarea de staniu
Elementul chimic este staniu. Proprietățile și aplicarea de staniu Metale feroase și neferoase. Utilizare, aplicarea metalelor neferoase. Metalele neferoase sunt ...
Metale feroase și neferoase. Utilizare, aplicarea metalelor neferoase. Metalele neferoase sunt ... Care este natura oxizilor
Care este natura oxizilor Bacterii chimosintetice: exemple. Rolul bacteriilor chimosintetice
Bacterii chimosintetice: exemple. Rolul bacteriilor chimosintetice Să vorbim despre cum să găsim protoni, neutroni și electroni
Să vorbim despre cum să găsim protoni, neutroni și electroni Ce este metalul? Proprietăți și caracteristici ale metalelor
Ce este metalul? Proprietăți și caracteristici ale metalelor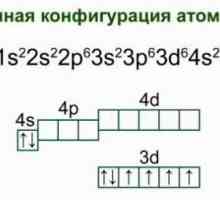 Fier: structura atomului, schema și exemple. Structura electronică a atomului de fier
Fier: structura atomului, schema și exemple. Structura electronică a atomului de fier Valence de fier. Care este valența fierului?
Valence de fier. Care este valența fierului? Chimie anorganică. Chimie generală și anorganică
Chimie anorganică. Chimie generală și anorganică Tipuri de reacții chimice
Tipuri de reacții chimice Legea periodică
Legea periodică Reacții de oxidare-reducere
Reacții de oxidare-reducere Eteri. trăsătură
Eteri. trăsătură Substanțe simple
Substanțe simple Metalele amfoterice și proprietățile acestora
Metalele amfoterice și proprietățile acestora Proprietățile fizice și chimice ale metalelor
Proprietățile fizice și chimice ale metalelor
 Pyrite (fierite de fier): proprietăți fizice și magice. Aplicarea mineralelor în industrie
Pyrite (fierite de fier): proprietăți fizice și magice. Aplicarea mineralelor în industrie Care este valența sulfului? Posibile valențe de sulf
Care este valența sulfului? Posibile valențe de sulf Metode de obținere a metalelor. Tipuri de aliaje. Producția de metale alcaline
Metode de obținere a metalelor. Tipuri de aliaje. Producția de metale alcaline Este cuprul un corp sau o substanță? Proprietățile cuprului
Este cuprul un corp sau o substanță? Proprietățile cuprului Elementul chimic este staniu. Proprietățile și aplicarea de staniu
Elementul chimic este staniu. Proprietățile și aplicarea de staniu Metale feroase și neferoase. Utilizare, aplicarea metalelor neferoase. Metalele neferoase sunt ...
Metale feroase și neferoase. Utilizare, aplicarea metalelor neferoase. Metalele neferoase sunt ... Care este natura oxizilor
Care este natura oxizilor Bacterii chimosintetice: exemple. Rolul bacteriilor chimosintetice
Bacterii chimosintetice: exemple. Rolul bacteriilor chimosintetice Să vorbim despre cum să găsim protoni, neutroni și electroni
Să vorbim despre cum să găsim protoni, neutroni și electroni Ce este metalul? Proprietăți și caracteristici ale metalelor
Ce este metalul? Proprietăți și caracteristici ale metalelor