Adăugarea electrofilă în chimia organică
Reacțiile de adiție sunt caracterizate prin formarea unui compus chimic din două sau mai multe produse de pornire. Considerăm că mecanismul de adăugare electrofilă este convenabil pentru exemplul hidrocarburilor aciclice alchenice - nesaturate cu o dublă legătură. În afară de acestea, alte hidrocarburi cu legături multiple, inclusiv cele ciclice, intră în astfel de transformări.
conținut
- Etapele interacțiunii moleculelor inițiale
- Efectul substituenților asupra vitezei de reacție
- Mecanismul de adăugare a halogenurilor
- Mecanismul de adiție a acizilor halogenați
- Direcția reacției dintre reactivii asimetrici și regula markovnikov
- Efectul substituentului care îndepărtează electronul pe parcursul interacțiunii
Etapele interacțiunii moleculelor inițiale
Alăturarea electrofilă are loc în mai multe etape. Electrofilul, care are o sarcină pozitivă, acționează ca un acceptor de electroni, iar dubla legătură a moleculei de alchenă joacă rolul unui donator de electroni. Ambii compuși formează mai întâi un complex p-instabil. Apoi începe transformarea pi-complex în complexul.. Formarea carbococului în această etapă și stabilitatea acestuia determină rata de interacțiune ca întreg. După aceasta, carbocularea interacționează rapid cu un nucleofil încărcat parțial negativ și se formează produsul final al transformării.

Efectul substituenților asupra vitezei de reacție
Delocalizarea încărcării (ϭ +) în carbocitare depinde de structura moleculei inițiale. Efectul inductiv pozitiv pe care îl prezintă grupa alchil duce la o încărcare mai mică a atomului de carbon învecinat. Ca rezultat, în moleculă cu un substituent donor de electroni, crește stabilitatea relativă a cationului, densitatea electronului pi - legături și reactivitatea moleculei ca un întreg. Efectul acceptorilor de electroni asupra reactivității va fi opus.
Mecanismul de adăugare a halogenurilor
Să analizăm mai detaliat mecanismul reacției de adăugare electrofilă prin exemplul interacțiunii alchenă și halogen.
- Moleculele de halogen se apropie de legătura dublă dintre atomii de carbon și polarizează. Datorită unei sarcini parțial pozitive la un capăt al moleculei, halogenul trage pe ele însele electroni pi - conexiune. Acesta este modul în care un instabil pi - complex.
- În etapa următoare, particula electrofilă se combină cu doi atomi de carbon pentru a forma un ciclu. Apare un ion ciclic "onium".
- Partea de halogen încărcată rămasă (nucleofil încărcat pozitiv) reacționează cu ionul de onium și este conectată pe partea opusă a particulelor de halogen anterioare. Se prezintă produsul final, trans-1,2-dihalogenalcan. În mod similar, adăugarea de halogen la cicloalchenă.
Mecanismul de adiție a acizilor halogenați

Reacțiile de adiție electrofilă a halogenurilor de hidrogen și a acidului sulfuric au loc în mod diferit. Într-un mediu acid reactivul disociază într-un cation și un anion. Un atac ionic pozitiv (electrofil) pi este o legătură, este legată la unul dintre atomii de carbon. O formă de carbocitare în care atomul de carbon învecinat este încărcat pozitiv. În plus, carbocarea reacționează cu anionul pentru a forma produsul de reacție final.
Direcția reacției dintre reactivii asimetrici și regula Markovnikov

Atașamentul electrofil între două molecule asimetrice se desfășoară regioselectiv. Aceasta înseamnă că se formează numai unul dintre cei doi izomeri posibili. Regioselectivitatea descrie Principiul lui Markovnikov, conform căruia hidrogenul este atașat la un atom de carbon, legat de un număr mare de alți atomi de hidrogen (la unul mai hidrogenat).
Pentru a înțelege esența acestei reguli, trebuie reținut faptul că viteza de reacție depinde de stabilitatea carbococului intermediar. Influența substituenților electron donor și acceptor a fost discutată mai sus. Astfel, adăugarea electrofilă a acidului bromhidric la propen va conduce la formarea de 2-brompropan. Un cation intermediar cu o sarcină pozitivă pe un atom central de carbon este mai stabil decât o carbocare cu o sarcină pozitivă la atomul extrem. Ca rezultat, atomul de brom interacționează cu al doilea atom de carbon.

Efectul substituentului care îndepărtează electronul pe parcursul interacțiunii
Dacă molecula parentală conține un substituent care îndepărtează electronul care are un efect negativ inductiv și / sau mezomeric, atașarea electrofilă merge împotriva regulii descrise mai sus. Exemple de astfel de substituenți sunt CF3, COOH, CN. În acest caz, distanța mare a încărcăturii pozitive de la grupul de extragere a electronilor face caracterizarea primară mai stabilă. Ca rezultat, hidrogenul combină cu un atom de carbon mai puțin hidrogenat.
Varianta universală a regulii va arăta astfel: atunci când o alchenă asimetrică și un reactiv asimetric interacționează, reacția se desfășoară de-a lungul căii de formare a celei mai stabile carbocații.
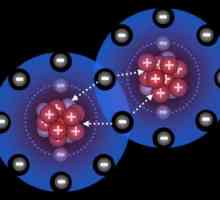 Mecanismul donator-acceptor: exemple. Ce este un mecanism donator-acceptor?
Mecanismul donator-acceptor: exemple. Ce este un mecanism donator-acceptor? Formula benzenului: care dintre variante este corectă?
Formula benzenului: care dintre variante este corectă?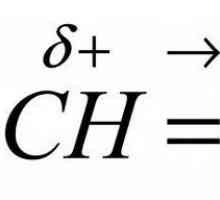 Regula Markovnikova V. V. Esență și exemple
Regula Markovnikova V. V. Esență și exemple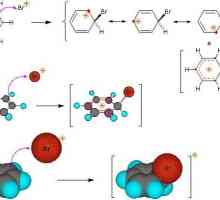 Reacțiile de substituție: descriere, ecuație, exemple
Reacțiile de substituție: descriere, ecuație, exemple Hidrocarburi halogenate: producție, proprietăți chimice, aplicare
Hidrocarburi halogenate: producție, proprietăți chimice, aplicare Metode de producere a alchenelor: laborator și industrial
Metode de producere a alchenelor: laborator și industrial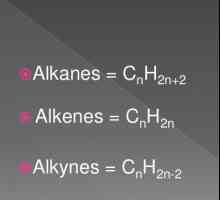 Formula generală a alchenelor. Proprietățile și caracteristicile alkenelor
Formula generală a alchenelor. Proprietățile și caracteristicile alkenelor Ce este OVR în chimia modernă?
Ce este OVR în chimia modernă? Legătura donor-acceptor: exemple de substanțe
Legătura donor-acceptor: exemple de substanțe Ce este polimerizarea în chimia organică
Ce este polimerizarea în chimia organică Reacții calitative la alchene. Proprietăți chimice și structura alchenelor
Reacții calitative la alchene. Proprietăți chimice și structura alchenelor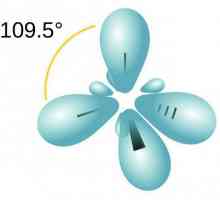 Să vorbim despre cum să determinăm tipul de hibridizare
Să vorbim despre cum să determinăm tipul de hibridizare Ce este o nomenclatură sistematică
Ce este o nomenclatură sistematică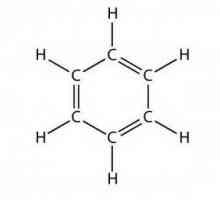 Ce este benzenul? Structura benzenului, formula, proprietățile, aplicația
Ce este benzenul? Structura benzenului, formula, proprietățile, aplicația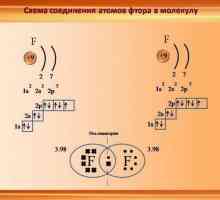 Caracteristicile legăturii covalente. Pentru care substanțele este o legătură covalentă
Caracteristicile legăturii covalente. Pentru care substanțele este o legătură covalentă Hidrocarburi limită: caracteristici generale, izomerie, proprietăți chimice
Hidrocarburi limită: caracteristici generale, izomerie, proprietăți chimice Mecanism de acțiune al enzimelor
Mecanism de acțiune al enzimelor Hidrocarburi nesaturate: alcene, proprietăți chimice și aplicații
Hidrocarburi nesaturate: alcene, proprietăți chimice și aplicații Îmbinarea metalică
Îmbinarea metalică Legarea ionilor
Legarea ionilor Proprietăți chimice ale alchenelor (olefine)
Proprietăți chimice ale alchenelor (olefine)
 Formula benzenului: care dintre variante este corectă?
Formula benzenului: care dintre variante este corectă? Regula Markovnikova V. V. Esență și exemple
Regula Markovnikova V. V. Esență și exemple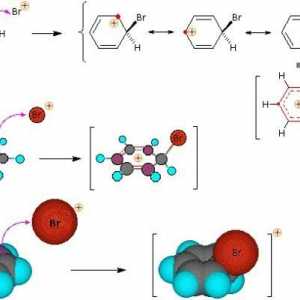 Reacțiile de substituție: descriere, ecuație, exemple
Reacțiile de substituție: descriere, ecuație, exemple Hidrocarburi halogenate: producție, proprietăți chimice, aplicare
Hidrocarburi halogenate: producție, proprietăți chimice, aplicare Metode de producere a alchenelor: laborator și industrial
Metode de producere a alchenelor: laborator și industrial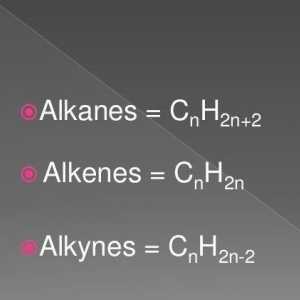 Formula generală a alchenelor. Proprietățile și caracteristicile alkenelor
Formula generală a alchenelor. Proprietățile și caracteristicile alkenelor Ce este OVR în chimia modernă?
Ce este OVR în chimia modernă? Legătura donor-acceptor: exemple de substanțe
Legătura donor-acceptor: exemple de substanțe Ce este polimerizarea în chimia organică
Ce este polimerizarea în chimia organică Reacții calitative la alchene. Proprietăți chimice și structura alchenelor
Reacții calitative la alchene. Proprietăți chimice și structura alchenelor