Legătura donor-acceptor: exemple de substanțe
Donorul-acceptor de legare, sau de coordonare, este un fel de legătura covalentă. Descoperim trăsăturile distinctive ale acestui tip de conexiune, vom da exemple care demonstrează formarea ei.
conținut

Legătura covalentă
În primul rând, vom selecta caracteristici distinctive legătura chimică cea mai covalentă.
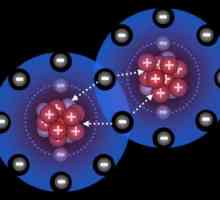
Poate fi polar și nepolar, în funcție de poziția perechii de electroni dintre atomi. Dacă se produce o deplasare parțială a densității electronilor către unul dintre atomi, un polar covalent legătură chimică. Un fenomen similar este posibil prin formarea unei legături între nemetalii cu electronegativitate diferită. Atunci când crește, apare o schimbare semnificativă a perechii de electroni către atomul cu un exponent mare de EO. Atunci când se formează o legătură între nonmetalii având aceeași valoare de electronegativitate, nu există o deplasare a unei perechi de electroni, o astfel de conexiune se numește nonpolar.
Exemple sunt oxigenul, hidrogenul, ozonul, fosforul. Conexiunea polară este acid clorhidric, apă, amoniac.
Există un termen special prin care se poate caracteriza numărul de perechi de electroni formate între atomi.
Considerând că doi electroni sunt necesari pentru a forma o legătură, vor exista trei legături între atomii de azot, adică multiplicitatea corespunde a trei. Legarea donor-acceptor este un caz special al unei legături covalente polar, dar se presupune interacțiunea intermoleculară a substanțelor.

Caracteristicile mecanismului
Pentru a forma o legătură covalentă suficientă interacțiune convențională între doi electroni (perechi total). Donor bond-acceptor format prin chimic printr-o pereche de electroni dintr-o parte (de la un donator), gol (gratuit) pe orbita altui atom (acceptor). În cazul covalent polar (nonpolar) și în interacțiunea donor-acceptor, electronii devin în cele din urmă obișnuiți.

Formarea cationilor de amoniu
Cum se formează legătura donor-acceptor? Exemple de substanțe date în cursul ciclului școlar secundar sunt limitate la cationii de amoniu. Să ne analizăm educația în detaliu.
Azotul, care face parte din molecula de amoniac, se află în al cincilea grup (principalul subgrup) al tabelului periodic. Pe exterior nivel energetic există cinci electroni. Când o moleculă de amoniac este formată într-o legătură polară covalentă, azotul dă trei electroni, astfel încât o pereche de electroni care nu participă la un astfel de proces rămâne nefolosită.
Aceasta este cea care îi dă dreptul de a manifesta proprietățile donatorului atunci când moleculele de amoniac vin împreună cu dipolii de apă. În apă, cationul de hidrogen nu are propriul său electron, deci prezintă proprietățile acceptorului.
In momentul in care moleculele de amoniac sunt destul de aproape de protoni de hidrogen din apă, nor de azot format din doi electroni se transformă în cation atracție hidrogen, devine punct comun. Rezultatul este formarea mecanismului donor-acceptor conexiune tetravalent între azot și hidrogen, se presupune. Aceasta este ceea ce se numește un exemplu clasic de formarea unei legături.
Formarea cationilor de oxoniu
În curriculum-ul școlar (nivelul de bază), nu se ia în considerare cationul de oxoniu (hidroxoniu), deoarece teoria protolitică a soluțiilor este studiată doar la nivelul profilului. Deoarece legătura donor-acceptor este de asemenea utilizată aici, exemple de formare a acestuia vor fi luate în considerare mai detaliat.
Ca donator în acest caz va acționa o moleculă de apă, iar protonul prezintă proprietățile acceptorului. Mecanismul donator-acceptor luat în considerare este ceea ce se numește baza chimiei compușilor complexi și, prin urmare, merită o atenție deosebită. El explică esența teoriei descompunerii electrolitice a acizilor, sărurilor, bazelor atunci când sunt dizolvate în apă în cationi și anioni.
Atunci când o astfel de conexiune este forțată, se produce penetrarea electronilor legați în carcasa exterioară a atomilor legați de ele. În acest caz, există o creștere a numărului de electroni pe cochiliile exterioare cu unul.

Al doilea algoritm de formare a comunicării
Există un alt mecanism prin care se formează o legătură donor-acceptor. Exemple de astfel de interacțiuni sunt numeroase, în special formarea de fluoruri metalice. Se observă utilizarea unei perechi de electroni a unuia dintre atomii de reacție. Ca rezultat, un atom își completează cochilia la maximum, dar nu toți cei opt electroni participă la conexiune, doar o anumită parte dintre ei. Acei electroni care nu participă la conexiune sunt numiți liberi și, cu ajutorul celorlalți, se creează o legătură donator-acceptor. Exemple de astfel de variante ale legăturii donor-acceptor se referă la formarea de fluoruri ale metalelor alcaline și alcalino-pământoase. De exemplu, fluorura de sodiu, potasiu, calciu este preparată în mod similar.
Care este diferența dintre o legătură donator-acceptor? Este posibil să se identifice compuși stabili care apar datorită unui mecanism similar pentru formarea compușilor chimici. De exemplu, dizolvarea acidului fluorhidric în apă, legătura dintre amoniac și clorura de aluminiu, conducând la formarea de compuși complexe.

concluzie
Ținând cont de regulile interacțiunii donor-acceptor, menționăm că gaze inerte pot acționa ca donatori activi, deoarece au numărul maxim de electroni pe carcasa exterioară. Din punct de vedere experimental, o astfel de afirmație a fost confirmată pe deplin și s-au descoperit oxizii gazelor inerte formate exact prin interacțiunea donator-acceptor.
Acest tip de legătura covalentă are o semnificație specială în viața umană. În plus față de participarea activă în viața sa, datorită comunicării donor-acceptor, este posibilă crearea de produse alimentare, diverse preparate farmaceutice. De exemplu, mecanismul de formare a cationilor de amoniu considerat mai sus se referă la formarea de amoniac, care este utilizat pe scară largă în medicina modernă.
 Mecanismul donator-acceptor: exemple. Ce este un mecanism donator-acceptor?
Mecanismul donator-acceptor: exemple. Ce este un mecanism donator-acceptor? Care este valența sulfului? Posibile valențe de sulf
Care este valența sulfului? Posibile valențe de sulf Formula benzenului: care dintre variante este corectă?
Formula benzenului: care dintre variante este corectă? Legătura metalică: mecanismul educației. Legături chimice metalice: exemple
Legătura metalică: mecanismul educației. Legături chimice metalice: exemple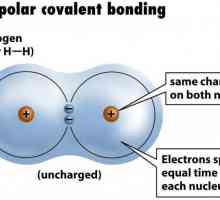 Un exemplu de legătură covalentă nepolară. Legătura covalentă este polară și nepolară
Un exemplu de legătură covalentă nepolară. Legătura covalentă este polară și nepolară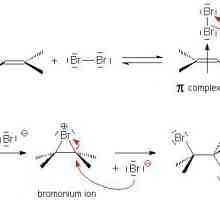 Adăugarea electrofilă în chimia organică
Adăugarea electrofilă în chimia organică Să vorbim despre cum să determinăm tipul de hibridizare
Să vorbim despre cum să determinăm tipul de hibridizare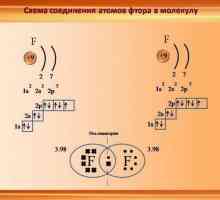 Caracteristicile legăturii covalente. Pentru care substanțele este o legătură covalentă
Caracteristicile legăturii covalente. Pentru care substanțele este o legătură covalentă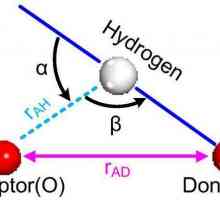 Legătura cu hidrogen: exemple și tipuri de legături chimice
Legătura cu hidrogen: exemple și tipuri de legături chimice Principalele tipuri de legături chimice: de ce și cum sunt formate
Principalele tipuri de legături chimice: de ce și cum sunt formate Legătura covalentă
Legătura covalentă Dielectrice într-un câmp electric
Dielectrice într-un câmp electric Ce este o legătură de hidrogen? Tipuri, influență
Ce este o legătură de hidrogen? Tipuri, influență Ce este o legătură covalentă polară
Ce este o legătură covalentă polară Îmbinarea metalică
Îmbinarea metalică Legarea ionilor
Legarea ionilor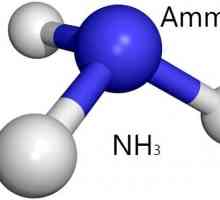 Amoniu este un ion de interacțiune donor-acceptor
Amoniu este un ion de interacțiune donor-acceptor Formula structurală este o reprezentare grafică a unei substanțe
Formula structurală este o reprezentare grafică a unei substanțe Legătura chimică: definiția, tipurile, clasificarea și caracteristicile definiției
Legătura chimică: definiția, tipurile, clasificarea și caracteristicile definiției Bazele chimiei anorganice. Grad de oxidare
Bazele chimiei anorganice. Grad de oxidare Legătura covalentă nepolară este o legătură chimică formată din atomi identici
Legătura covalentă nepolară este o legătură chimică formată din atomi identici
 Care este valența sulfului? Posibile valențe de sulf
Care este valența sulfului? Posibile valențe de sulf Formula benzenului: care dintre variante este corectă?
Formula benzenului: care dintre variante este corectă? Legătura metalică: mecanismul educației. Legături chimice metalice: exemple
Legătura metalică: mecanismul educației. Legături chimice metalice: exemple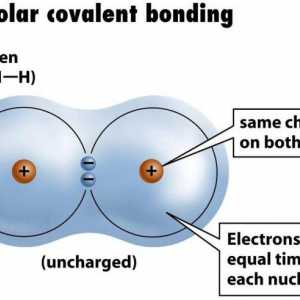 Un exemplu de legătură covalentă nepolară. Legătura covalentă este polară și nepolară
Un exemplu de legătură covalentă nepolară. Legătura covalentă este polară și nepolară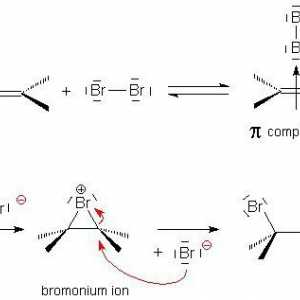 Adăugarea electrofilă în chimia organică
Adăugarea electrofilă în chimia organică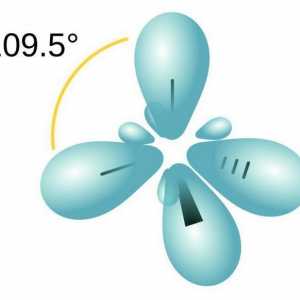 Să vorbim despre cum să determinăm tipul de hibridizare
Să vorbim despre cum să determinăm tipul de hibridizare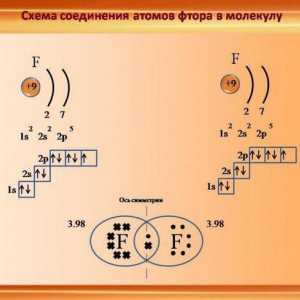 Caracteristicile legăturii covalente. Pentru care substanțele este o legătură covalentă
Caracteristicile legăturii covalente. Pentru care substanțele este o legătură covalentă Legătura cu hidrogen: exemple și tipuri de legături chimice
Legătura cu hidrogen: exemple și tipuri de legături chimice