Specificitatea enzimei: tipuri și trăsături ale acțiunii
Cuvântul "enzimă" are rădăcini latine. În traducere, înseamnă "aluat". În limba engleză, se utilizează termenul "enzimă", derivat din termenul grecesc, care înseamnă același lucru. Enzimele se numesc proteine specializate. Ele se formează în celule și au capacitatea de a accelera cursul proceselor biochimice. Cu alte cuvinte, acționează ca catalizatori biologici.
conținut

Caracteristici generale
Manifestarea activității catalitice a anumitor enzime se datorează prezenței unui număr de compuși neproteici. Ele sunt numite cofactori. Ele sunt împărțite în două grupe: ioni metalici și o serie de substanțe anorganice, precum și coenzime (compuși organici).
Mecanismul de activitate
Prin natura lor chimică, enzimele aparțin unui grup de proteine. Cu toate acestea, spre deosebire de cele din urmă, elementele în cauză conțin un centru activ. Este un complex unic de grupuri funcționale de reziduuri de aminoacizi. Ele sunt strict orientate în spațiu datorită structurii terțiare sau cuaternare a enzimei. În centrul activ, regiunile catalitice și substrat sunt izolate. Aceasta din urmă determină specificitatea enzimelor. Substratul este substanța la care acționează proteina. Anterior sa crezut că interacțiunea lor se desfășoară pe principiul "cheie la blocare". Cu alte cuvinte, centrul activ trebuie să corespundă în mod clar substratului. În prezent, există o ipoteză diferită. Se crede că corespondența exactă este inițial absentă, dar apare în timpul interacțiunii substanțelor. Al doilea sit catalitic afectează specificitatea acțiunii. Cu alte cuvinte, determină natura reacției accelerate. 
structură
Toate enzimele sunt împărțite în una și două componente. Primii au o structură similară cu aceea a proteinelor simple. Acestea conțin exclusiv aminoacizi. Al doilea grup - proteine - include părți proteice și non-proteine. Ultimul este coenzima, primul este apoenzima. Aceasta din urmă determină specificitatea substratului enzimei. Aceasta înseamnă că acționează ca un substrat în centrul activ. Coenzima, respectiv, acționează ca o regiune catalitică. Specificitatea acțiunii este asociată cu aceasta. Deoarece coenzimele, vitaminele, metalele și alți compuși cu conținut scăzut de molecule pot acționa.
cataliză
Apariția oricărei reacții chimice este asociată cu coliziunea moleculelor de substanțe care interacționează. Mișcarea lor în sistem este determinată de prezența energiei libere potențiale. Pentru o reacție chimică, este necesar ca moleculele să adopte o stare de tranziție. Cu alte cuvinte, ei trebuie să aibă suficientă forță pentru a trece prin bariera energetică. Acesta reprezintă volumul minim de energie pentru a da reactivității tuturor moleculelor. Toți catalizatorii, inclusiv enzimele, pot reduce bariera energetică. Aceasta promovează un curs accelerat al reacției. 
Care este specificitatea enzimelor?
Această abilitate este exprimată în accelerarea unei anumite reacții. Enzimele pot afecta același substrat. Cu toate acestea, fiecare dintre ele va accelera doar o reacție specifică. Specificitatea reactivă a enzimei poate fi urmărită la un exemplu piruvat dehidrogenază complex. Aceasta include proteine care afectează PVC-ul. Principalele sunt: dehidrogenaza piruvat, decarboxilaza piruvat, acetiltransferaza. Reacția însăși se numește decarboxilare oxidativă a PVC-ului. Produsul său acționează ca acid acetic.
clasificare
Există următoarele tipuri de specificitate enzimatică:
- Stereochimie. Se exprimă în capacitatea unei substanțe de a influența unul dintre stereoizomerii posibili ai substratului. De exemplu, hidrataza de fumarat este capabilă să acționeze asupra fumaratului. Cu toate acestea, nu afectează izomerul cis-acidul maleic.
- Absolut. Specificitatea enzimelor Acest tip este exprimat în capacitatea unei substanțe de a afecta numai un anumit substrat. De exemplu, sucroza reacționează exclusiv cu zaharoză, arginază - cu arginină și așa mai departe.
- Relativă. Specificitatea enzimelor în acest caz este exprimată în capacitatea unei substanțe de a afecta un grup de substraturi care au o legătură de același tip. De exemplu, alfa-amilaza reacționează cu glicogen și amidon. Ei au o legătură de tipul glicozidelor. Trypsina, pepsina, chymotripsina afectează multe proteine din grupul peptidic.

temperatură
Enzimele au specificitate în anumite condiții. Pentru majoritatea dintre ele, temperatura optimă este de + 35 grade - + 45 grade. Când substanța este plasată în condiții cu indici inferiori, activitatea acesteia va scădea. Această condiție se numește inactivare reversibilă. Pe măsură ce crește temperatura, abilitățile sale vor fi restaurate. Merită să spunem că dacă introduceți condiții în care t este mai mare decât valorile specificate, va apărea și inactivarea. Cu toate acestea, în acest caz va fi ireversibil, deoarece nu se recuperează cu scăderea temperaturii. Aceasta se datorează denaturării moleculei.
Efectul pH-ului
Încărcarea moleculei depinde de aciditate. În consecință, pH-ul afectează activitatea situsului activ și specificitatea enzimei. Indicele optim de aciditate pentru fiecare substanță este diferit. Cu toate acestea, în majoritatea cazurilor este 4-7. De exemplu, pentru amilaza alfa salivară, aciditatea optimă este de 6,8. Între timp, există o serie de excepții. Aciditatea optimă a pepsinei, de exemplu, 1,5-2,0, chymotripsină și tripsină - 8-9. 
concentrare
Cu cât este mai mare enzima, cu atât este mai mare rata de reacție. O concluzie similară poate fi făcută despre concentrația substratului. Totuși, teoretic, conținutul de saturație al țintă este determinat pentru fiecare substanță. Cu aceasta toate centrele active vor fi ocupate de substratul existent. În acest caz, specificitatea enzimei va fi maximă, indiferent de adăugarea ulterioară a țintelor.
Substanță regulatori
Acestea pot fi împărțite în inhibitori și activatori. Ambele categorii sunt împărțite în nespecific și specific. Pentru acest ultim tip includ săruri avtivatoram zhelchnokislye (pentru glanda lipază podzheluzhochnoy), ionii de clor (alfa-amilaza), acid clorhidric (pentru pepsină). Activatori nespecifici ioni de magneziu, care afectează kinaze și fosfataze și inhibitori specifici - peptide terminale proenzime. Acestea din urmă sunt forme inactive de substanțe. Acestea sunt activate prin scindarea peptidelor terminale. Tipurile lor specifice corespund fiecărei proenzime individuale. De exemplu, într-o formă inactivă, tripsina este produsă sub formă de tripsinogen. Centrul său activ este închis cu o hexapeptidă terminală, care este un inhibitor specific. În procesul de activare, se desparte. Centrul activ al tripsinei ca urmare a acestui lucru devine deschis. Inhibitorii nespecifici sunt sărurile din metale grele. De exemplu, sulfat de cupru. Ele provoacă denaturarea compușilor. 
inhibiție
Poate fi competitivă. Acest fenomen este exprimat în apariția unei asemănări structurale între inhibitor și substrat. Ei intră într-o luptă pentru comunicarea cu centrul activ. Dacă conținutul inhibitorului este mai mare decât cel al substratului, se formează un inhibitor de enzime coplex. Când se adaugă substanța țintă, raportul se modifică. Ca urmare, inhibitorul va fi înlocuit. De exemplu, succinatul pentru succinat dehidrogenază acționează ca un substrat. Inhibitorii sunt oxaloacetat sau malonat. Influența produselor de reacție este considerată competitivă. Adesea ele sunt ca substraturi. De exemplu, pentru glucoza-6-fosfat, produsul este glucoza. Substratul va fi fosfat de glucoză-6. Inhibarea necompetitivă nu implică o asemănare structurală între substanțe. Inhibitorul și substratul se pot lega simultan de enzima. Aceasta conduce la formarea unui compus nou. El este un inhibitor enzimatic complex-substrat. În timpul interacțiunii, centrul activ este blocat. Aceasta se datorează legării inhibitorului la situsul catalitic al situsului activ. Un exemplu este citocrom oxidaza. Pentru această enzimă, oxigenul acționează ca un substrat. Inhibitorii citocrom oxidazei sunt sărurile acidului cianhidric. 
Regulamentul alosteric
În unele cazuri, în plus față de centrul activ care determină specificitatea enzimei, există încă o legătură. Ca o componentă alosterică. Dacă este asociat un activator cu același nume, eficacitatea enzimei este crescută. Dacă inhibitorul intră în reacția cu centrul alosteric, atunci activitatea substanței, respectiv, scade. De exemplu, adenilat ciclaza și guanilat ciclaza se referă la enzime cu reglarea tipului allosteric.
 Enzima enzimă. Rata nivelului de activitate
Enzima enzimă. Rata nivelului de activitate Enzima este un catalizator pentru procesele biochimice din organism
Enzima este un catalizator pentru procesele biochimice din organism Membrană celulară și rolul său biologic
Membrană celulară și rolul său biologic Care este funcția enzimatică a proteinelor? Funcția enzimatică a proteinelor: exemple
Care este funcția enzimatică a proteinelor? Funcția enzimatică a proteinelor: exemple Ce se numesc catalizatori biologici? Enzimele ca catalizatori biologici
Ce se numesc catalizatori biologici? Enzimele ca catalizatori biologici Funcția enzimelor. Rolul enzimelor în organism
Funcția enzimelor. Rolul enzimelor în organism Proteinele: un rol biologic. Rolul biologic al proteinei în organism
Proteinele: un rol biologic. Rolul biologic al proteinei în organism Biochimia enzimelor. Structura, proprietățile și funcțiile
Biochimia enzimelor. Structura, proprietățile și funcțiile Proteina-enzimă: rolul, proprietățile, funcția proteinelor-enzimelor din organism
Proteina-enzimă: rolul, proprietățile, funcția proteinelor-enzimelor din organism Substanțe anorganice
Substanțe anorganice Reglarea activității enzimei și a metodelor sale
Reglarea activității enzimei și a metodelor sale Enzime imobilizate și utilizarea lor
Enzime imobilizate și utilizarea lor Centrul activ al enzimei: structura, proprietățile. Cine a descoperit centrul activ al enzimei? Ce…
Centrul activ al enzimei: structura, proprietățile. Cine a descoperit centrul activ al enzimei? Ce…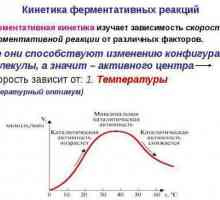 Kinetica reacțiilor enzimatice - descriere, caracteristici și tabel
Kinetica reacțiilor enzimatice - descriere, caracteristici și tabel Aplicarea enzimelor în medicină
Aplicarea enzimelor în medicină Coenzimele sunt molecule mici de natură non-proteică. Structura și aplicarea coenzimelor
Coenzimele sunt molecule mici de natură non-proteică. Structura și aplicarea coenzimelor Ce sunt enzimele?
Ce sunt enzimele? Compoziția chimică a celulei
Compoziția chimică a celulei Mecanism de acțiune al enzimelor
Mecanism de acțiune al enzimelor Cele mai mari celule de materie organică
Cele mai mari celule de materie organică Celule de materie organică și anorganică
Celule de materie organică și anorganică
 Enzima este un catalizator pentru procesele biochimice din organism
Enzima este un catalizator pentru procesele biochimice din organism Care este funcția enzimatică a proteinelor? Funcția enzimatică a proteinelor: exemple
Care este funcția enzimatică a proteinelor? Funcția enzimatică a proteinelor: exemple Ce se numesc catalizatori biologici? Enzimele ca catalizatori biologici
Ce se numesc catalizatori biologici? Enzimele ca catalizatori biologici Funcția enzimelor. Rolul enzimelor în organism
Funcția enzimelor. Rolul enzimelor în organism Proteinele: un rol biologic. Rolul biologic al proteinei în organism
Proteinele: un rol biologic. Rolul biologic al proteinei în organism Biochimia enzimelor. Structura, proprietățile și funcțiile
Biochimia enzimelor. Structura, proprietățile și funcțiile Proteina-enzimă: rolul, proprietățile, funcția proteinelor-enzimelor din organism
Proteina-enzimă: rolul, proprietățile, funcția proteinelor-enzimelor din organism Reglarea activității enzimei și a metodelor sale
Reglarea activității enzimei și a metodelor sale