Reglarea activității enzimei și a metodelor sale
Fiind o unitate de materie vie, care funcționează ca un complex de biosisteme deschise, celula schimbă în mod constant substanțele și energia cu mediul extern. Pentru a menține homeostazia în ea există un grup de substanțe speciale de natură proteică - enzime. Structura, funcțiile și reglarea activității enzimatice sunt studiate de o ramură specială de biochimie, numită enzimologie. În acest articol, pe exemple specifice, vom lua în considerare diferite mecanisme și metode pentru reglarea activității enzimatice care sunt inerente mamiferelor și oamenilor mai înalți.
conținut
- Condiții necesare activității enzimatice optime
- Complex multienzim
- De ce este celula împărțită în compartimente
- Rolul enzimelor în metabolismul energetic
- Ce este inhibarea alosterică
- Enzimele de reglementare
- Cum se efectuează interacțiunea cu peptidele?
- Protomerii și rolul lor în biochimie
- Reglementarea chimică a activității enzimatice
- Proteoliza parțială
- Rolul concentrației substanțelor inițiale în metabolismul celulei
- Regulamentul alosteric
Condiții necesare activității enzimatice optime
Substanțele biologic active care afectează în mod selectiv atât reacțiile de asimilare, cât și scindarea, prezintă proprietățile lor catalitice în celule în anumite condiții. De exemplu, este important să aflați care parte a celulei este scursă proces chimic, în care participă enzimele. Datorită compartimentării (diviziunea citoplasmică în secțiuni) reacțiile antagoniste apar în diferitele sale părți și organoide.

Astfel, sinteza proteinelor se desfășoară în ribozomi și divizarea lor - în hialoplasmă. reglementarea activității celulare a enzimelor care catalizează reacțiile biochimice opuse, nu numai că asigură debitul optim al metabolismului, dar, de asemenea, previne formarea de căi metabolice inutile de energie.
Complex multienzim
Organizarea structurală și funcțională a enzimelor formează aparatul enzimatic al celulei. Majoritatea reacțiilor chimice care apar în el sunt legate între ele. Dacă într-un proces chimic în mai multe etape produsul primei reacții este un reactiv pentru reacția ulterioară, în acest caz aranjamentul spațial al enzimelor din celulă este deosebit de pronunțat.
Trebuie reamintit faptul că enzimele sunt, prin natura lor, proteine simple sau complexe. Și sensibilitatea lor la substratul celular se datorează în primul rând modificării configurației spațiale a structurii terțiare sau cuaternare a peptidei. Enzimele și reacționa la schimbări nu numai în parametrii celulare, cum ar fi compoziția chimică hyaloplasm, concentrația reactanților și a produșilor de reacție, temperatura, dar, de asemenea, la modificări ale celulelor vecine sau în fluidul extracelular.

De ce este celula împărțită în compartimente
Rezonabilitatea și logica aranjamentului naturii vii este pur și simplu uimitoare. Acest lucru se aplică în totalitate manifestărilor de viață caracteristice celulei. Pentru chimist om de știință destul de clar că reacțiile chimice enzimatice multidirecționale, de exemplu, sinteza glicolizei si glucoza nu poate proceda în același tub. Cum, deci, apar reacțiile opuse în hialoplasmul unei celule, care este substratul comportamentului lor? Se pare că, conținutul celulare - citosol, - în care procesele chimice antagoniste sunt realizate separate spațial și forme izolate loci - compartimente. Datorită reacțiilor metabolice ale mamiferelor superioare și oamenilor sunt reglementate în special cu precizie, iar produsele metabolice sunt transformate în formă, pătrunde cu ușurință prin pereții celulelor site-uri. Apoi își restabilește structura originală. În plus față de citosol, enzimele conținute în organite: ribozomi, mitocondrii, nucleu, lizozomi.
Rolul enzimelor în metabolismul energetic
Luați în considerare decarboxilarea oxidativă a piruvatului. Reglarea activității catalitice a enzimelor din acesta este bine studiată prin enzimologie. Acest proces biochimic are loc în mitocondriile - organele cu membrană dublă ale celulelor eucariote - și este un proces intermediar între scindarea anoxică a glucozei și ciclul Krebs. Complexul piruvat dehidrogenază - PDH - conține trei enzime. La mamifere mai mari si oamenii sa reduca întâmplă cu creșterea concentrației de acetil-CoA și NATH, adică, în cazul moleculelor alternative educaționale ale acetil oportunități-CoA. În cazul în care celula are nevoie de mai multe porțiuni de energie și necesită noi molecule acceptor pentru reacțiile de amplificare tricarboxilici ciclu de acid, enzimele sunt activate.

Ce este inhibarea alosterică
Reglarea activității enzimatice poate fi efectuată prin substanțe speciale - inhibitori catalitic. Ei se pot lega covalent de anumite loci ale enzimei, ocolind centrul său activ. Aceasta duce la deformarea structurii spațiale a catalizatorului și conduce în mod automat la o scădere a proprietăților sale enzimatice. Cu alte cuvinte, se produce reglarea alosterică a activității enzimatice. De asemenea, adăugăm că această formă de acțiune catalitică a enzimelor oligomerice inerente, adică acelea ale căror molecule constau din două sau mai multe subunități proteice polimerice. -PDH complex discutat în titlul anterior este doar conține trei enzimă oligomerice: piruvat dehidrogenază, o dehidrogenaza și degidrolipoil gidrolipoil transatsetilazu.
Enzimele de reglementare
Studiile în enzimologie au stabilit faptul că rata de reacții chimice depinde atât de concentrație cât și de activitatea catalizatorului. Cel mai adesea, căile metabolice conțin principalele enzime care reglează rata de reacție pe toate secțiunile sale.

Acestea sunt numite de reglementare și afectează, de obicei, reacția inițială a complexului și pot participa la cele mai multe procese chimice lente într-o reacție ireversibilă sau se alăture reactanții la punctele de ramură într-o cale metabolică.
Cum se efectuează interacțiunea cu peptidele?
Una dintre căile prin care reglează activitatea enzimelor în celulă este interacțiunea proteină-proteină. Despre ce vorbim? Adăugarea de proteine de reglare la molecula enzimei este realizată, ca rezultat al activării lor. De exemplu, enzima adenilat ciclazei situată pe suprafața interioară a membranei celulare și pot interacționa cu structuri, cum ar fi hormon de receptori și peptida dispus între ea și enzimă. Deoarece receptorul hormonului compus rezultat modificări de proteine confirmarea spațială intermediară, această metodă de îmbunătățire a proprietăților catalitice ale adenilat ciclazei în biochimie se numește „proteine de reglementare de activare aderare din cauza“.
Protomerii și rolul lor în biochimie
Acest grup de substanțe, altfel numite proteine kinaze, va accelera transportul de PO anionic43 pe grupele hidroxil ale aminoacizilor care intră în macromolecule peptidice. Reglementarea activității enzimelor protomers vor fi luate în considerare de către noi ca un exemplu de protein kinaza A. molecula - tetramer este compus din două catalitice și două subunități de reglementare și peptida nu funcționează ca catalizator atâta timp cât regiunea de reglementare pentru protomer atașată o moleculă patru cAMP. Aceasta determină o transformare a structurii spațiale a proteinelor reglatoare, care conduce la eliberarea a două particule proteice catalitice activate, adică la disocierea protomerilor. Dacă moleculele cAMP sunt separate de subunitățile de reglare, complexul de proteină kinază inactivă este din nou restaurat la tetramer, deoarece apare asocierea particulelor de peptidă catalitică și de reglare. Astfel, modurile de reglare a activității enzimatice menționate mai sus asigură caracterul lor reversibil.

Reglementarea chimică a activității enzimatice
Biochimia a studiat, de asemenea, astfel de mecanisme pentru reglarea activității enzimatice, cum ar fi fosforilarea, defosforilarea. Mecanismul de reglare a activității enzimatice în acest caz are următoarea formă: resturile de aminoacizi ale enzimei care conțin grupări OH-, modifică modificarea chimică a acestora datorită impactului fosfatazelor fosfoproteinice asupra acestora. În acest caz, corecția este centrul enzimatic activ, iar pentru unele enzime aceasta este cauza care le activează, iar pentru alții - inhibitorul. La rândul lor, proprietățile catalitice ale fosfatazelor fosfoproteine în sine sunt reglate de hormoni. De exemplu, amidonul animal - glicogen - și grăsime între mese sunt defalcate în tractul gastrointestinal, sau mai precis, în duoden sub influența glucagon - enzimei pancreatice.

Acest proces este sporit prin fosforilarea enzimelor trofice gastrointestinale. În perioada de digestie activă, atunci când alimentele provin din stomac în duoden, sinteza glucagonului este sporită. Insulina - o enzimă pancreatică produsă de celulele alfa ale insulelor Langerhans, - interactioneaza cu receptorul, incluzând fosforilarea același mecanism de enzime digestive.
Proteoliza parțială
După cum putem vedea, nivelurile de reglare a activității enzimatice în celulă sunt variate. Pentru enzimele care sunt în afara citosol sau organite (în plasma de sânge sau în tractul gastrointestinal), metoda de activare este procesul de hidroliza legăturilor peptidice CO-NH. Este necesar, deoarece astfel de enzime sunt sintetizate într-o formă inactivă. Partea peptidică este separată de molecula enzimei, iar centrul activ suferă modificări în structura rămasă a modificării. Aceasta conduce la faptul că enzima „include o stare de lucru“, adică, este în măsură să influențeze cursul procesului chimic. De exemplu, pancreatici enzimă inactivă nu trypsinogen scindează proteinele produse alimentare care intră în duoden. Se supune proteolizei sub acțiunea enteropeptidazei. După aceea, enzima este activată și acum se numește tripsină. Proteoliza parțială este un proces reversibil. Apare în astfel de cazuri ca activarea enzimelor care scindează polipeptidele în procesele de coagulare a sângelui.

Rolul concentrației substanțelor inițiale în metabolismul celulei
Reglementarea activității enzimei prin accesibilitatea substratului a fost parțial examinată de noi în subcapitolul "Complexul multi-enzimatic". Rata reacțiilor catalitice care trece în mai multe etape depinde în mare măsură de câte molecule ale substanței inițiale sunt în hialoplasmul celular sau în organele. Acest lucru se datorează faptului că rata metabolică a căii este direct proporțională cu concentrația materialului de pornire. Cu cât mai multe molecule ale reactivului sunt în citozol, cu atât mai mare este viteza tuturor reacțiilor chimice ulterioare.
Regulamentul alosteric
Enzime a căror activitate este controlată nu numai prin concentrarea materiile prime, reactivii, dar și substanțele efectoare, caracterizate prin așa numitul regulament alosteric. Mai des, astfel de enzime sunt reprezentate de produse intermediare ale unui metabolism într-o cușcă. Datorită efectoarelor, activitatea enzimelor este reglementată. Biochimie a demonstrat că acești compuși, numite enzime alosterice sunt foarte importante pentru metabolismul celulelor, deoarece acestea au o sensibilitate foarte ridicată la modificări ale homeostaziei sale. Dacă enzima inhibă reacția chimică, adică reduce viteza - este numit un efector negativ (inhibitor). În caz contrar, atunci când există o creștere a ratei de reacție, este un activator, un efector pozitiv. În majoritatea cazurilor, materiile prime, adică reactivii care intră în interacțiunile chimice, joacă rolul de activatori. Produsele finite, formate ca urmare a reacțiilor în mai multe etape, se comportă ca inhibitori. Acest tip de reglementare, bazat pe relația dintre concentrația de reactivi și produse, se numește heterotrofic.
 Organoidele celulare și funcțiile lor: diversitate, funcții și proprietăți
Organoidele celulare și funcțiile lor: diversitate, funcții și proprietăți Membrană celulară și rolul său biologic
Membrană celulară și rolul său biologic Care este funcția enzimatică a proteinelor? Funcția enzimatică a proteinelor: exemple
Care este funcția enzimatică a proteinelor? Funcția enzimatică a proteinelor: exemple Principalele procese ale vieții celulare
Principalele procese ale vieții celulare Funcția enzimelor. Rolul enzimelor în organism
Funcția enzimelor. Rolul enzimelor în organism Alanin aminotransferaza este crescută - un semn al proceselor inflamatorii și distrofice în organe
Alanin aminotransferaza este crescută - un semn al proceselor inflamatorii și distrofice în organe Ce sunt lizozomii: structura, compoziția și funcțiile lizozomilor
Ce sunt lizozomii: structura, compoziția și funcțiile lizozomilor Biochimia enzimelor. Structura, proprietățile și funcțiile
Biochimia enzimelor. Structura, proprietățile și funcțiile Celulă: alimente și clădiri. Valoarea nutriției celulare. Exemple de nutriție celulară
Celulă: alimente și clădiri. Valoarea nutriției celulare. Exemple de nutriție celulară Tipuri de organizare celulară a microorganismelor
Tipuri de organizare celulară a microorganismelor Proteina-enzimă: rolul, proprietățile, funcția proteinelor-enzimelor din organism
Proteina-enzimă: rolul, proprietățile, funcția proteinelor-enzimelor din organism Proteine simple și complexe. Structura, funcții, proprietăți, caracteristici, exemple de proteine…
Proteine simple și complexe. Structura, funcții, proprietăți, caracteristici, exemple de proteine… Structura lizozomilor și rolul lor în metabolismul celular
Structura lizozomilor și rolul lor în metabolismul celular Centrul activ al enzimei: structura, proprietățile. Cine a descoperit centrul activ al enzimei? Ce…
Centrul activ al enzimei: structura, proprietățile. Cine a descoperit centrul activ al enzimei? Ce… Educația, varietățile, structura și funcția lizozomilor
Educația, varietățile, structura și funcția lizozomilor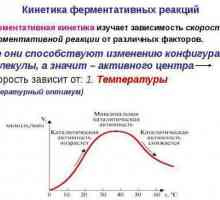 Kinetica reacțiilor enzimatice - descriere, caracteristici și tabel
Kinetica reacțiilor enzimatice - descriere, caracteristici și tabel Coenzimele sunt molecule mici de natură non-proteică. Structura și aplicarea coenzimelor
Coenzimele sunt molecule mici de natură non-proteică. Structura și aplicarea coenzimelor Ce sunt enzimele?
Ce sunt enzimele? Mecanism de acțiune al enzimelor
Mecanism de acțiune al enzimelor Celule de materie organică și anorganică
Celule de materie organică și anorganică Substanțe biologic active
Substanțe biologic active
 Care este funcția enzimatică a proteinelor? Funcția enzimatică a proteinelor: exemple
Care este funcția enzimatică a proteinelor? Funcția enzimatică a proteinelor: exemple Principalele procese ale vieții celulare
Principalele procese ale vieții celulare Funcția enzimelor. Rolul enzimelor în organism
Funcția enzimelor. Rolul enzimelor în organism Ce sunt lizozomii: structura, compoziția și funcțiile lizozomilor
Ce sunt lizozomii: structura, compoziția și funcțiile lizozomilor Biochimia enzimelor. Structura, proprietățile și funcțiile
Biochimia enzimelor. Structura, proprietățile și funcțiile Celulă: alimente și clădiri. Valoarea nutriției celulare. Exemple de nutriție celulară
Celulă: alimente și clădiri. Valoarea nutriției celulare. Exemple de nutriție celulară Tipuri de organizare celulară a microorganismelor
Tipuri de organizare celulară a microorganismelor Proteina-enzimă: rolul, proprietățile, funcția proteinelor-enzimelor din organism
Proteina-enzimă: rolul, proprietățile, funcția proteinelor-enzimelor din organism