Proprietăți chimice ale etilenglicolului, caracteristic. Alcoolul dihidric. Eterii etilenglicolului
Cele mai renumite și folosite în viața omului și în industria substanțelor aparținând categoriei de alcooli polihidroxilici sunt etilenglicolul și glicerina. Cercetarea și folosirea lor au început cu câteva secole în urmă, dar proprietățile acestora compuși organici
conținut
- Prima "cunoștință" cu etilen glicol și glicerină: istoria obținerii
- Structura și structura conexiunii
- Clasificarea afilierii
- Caracteristici fizice
- Metode de obținere
- Caracterizarea proprietăților chimice generale
- Reacții cu metale active
- Reacție calitativă pe etilen glicol
- Polimerizare
- Schimbul de hidroxil pentru halogen
- Prepararea eterilor
- Derivații cei mai importanți ai etilenglicolului
- Domenii de aplicare și politica prețurilor liniei de producție
Prima "cunoștință" cu etilen glicol și glicerină: istoria obținerii
În 1859 an, într-un proces în două etape dibromoetanului interacțiune cu acetat de argint și tratarea ulterioară cu hidroxid de potasiu obținută în prima reacție de etilenglicol, Charles Wurtz sintetizat glicol. Ceva timp mai târziu, am dezvoltat o metodă de dibrometan hidroliză directă, dar la scară industrială în începutul secolului XX alcool dihidric 1,2-dihidroxi etanului, he - monoetilenglicol sau un glicol, obținut prin hidroliza etilenei în Statele Unite.
Până în prezent, atât în industrie și în laborator a folosit o serie de alte metode, noi și mai eficiente cu materii prime și puncte de vedere energetic și ecologice, deoarece utilizarea reactivilor care conțin sau introducerea de clor, toxine, agenți cancerigeni, și alte dăunătoare pentru mediu și uman substanță, este redusă ca dezvoltarea chimiei "verzi".
Apothecary Carl Wilhelm Scheele în 1779 a fost descoperit glicerol, iar compoziția particulară a compusului a fost studiată în 1836 de Theophilus Julius Peluz. Două decenii mai târziu, structura moleculei acestui alcool trihidric a fost stabilită și justificată în scrierile lui Pierre Eugene Marcelia Vertello și Charles Wurz. În cele din urmă, după douăzeci de ani, Charles Friedel a realizat o sinteză completă de glicerină. În prezent, industria utilizează două metode de obținere a acesteia: prin intermediul clorurii de alil din propilenă și, de asemenea, prin acroleină. Proprietățile chimice ale etilenglicolului, cum ar fi glicerolul, sunt utilizate pe scară largă în diferite domenii ale producției chimice.
Structura și structura conexiunii
Molecula se bazează pe scheletul hidrocarburilor nesaturate din etilenă, constând din doi atomi de carbon, în care se rupe o dublă legătură. Două grupări hidroxil s-au alăturat locurilor de valență eliberate la atomii de carbon. Formula etilenă - C2H4, după ruperea legăturii macaralei și adăugarea de grupări hidroxil (după mai multe etape), se pare că C2H4(OH)2. Acesta este etilenglicolul.
moleculă de etilenă caracterizată printr-o structură liniară, în timp ce alcoolul dihidric are o anumită similitudine konfigurtsii trans în plasarea grupărilor hidroxil în raport cu coloana vertebrală de carbon și unul cu altul (se aplică integral termenul respectiv la o poziție în raport cu legătura multiplă). O astfel de dislocare corespunde locației la distanță a hidrogenii grupelor funcționale, energie mai mici, și deci - stabilitate maximă a sistemului. Pur și simplu, un ON-grup "privește" în sus, iar celălalt - în jos. În același timp, sunt compus instabil cu două grupări hidroxil: cu un atom de carbon, pentru a forma un amestec de reacție, ele deshidratează imediat, trecând în aldehide.
Clasificarea afilierii
Proprietățile chimice ale etilenglicol este determinată de originea sa din grupul format din alcooli polihidroxilici, și anume subgrupe dioli, adică compușii cu două fragmente hidroxil de pe atomii de carbon adiacenți. O substanță care conține și mai mulți substituenți OH este de asemenea glicerină. Are trei grupuri funcționale ale alcoolului și este cel mai comun reprezentant al subclasei sale.
Mulți compuși din această clasă sunt, de asemenea, produși și utilizați în producția chimică pentru diferite sinteze și alte scopuri, dar utilizarea etilenglicolului are o scală mai gravă și este utilizată în aproape toate industriile. Această întrebare va fi examinată mai detaliat mai jos.
Caracteristici fizice
Utilizarea etilenglicolului este explicată prin prezența unui număr de proprietăți inerente alcoolilor polihidrici. Acestea sunt trăsăturile caracteristice caracteristice numai unei anumite clase de compuși organici.
Cel mai important dintre proprietăți este capacitatea nelimitată de a se amesteca cu H2O. Apa + etilenglicol dă o soluție având o caracteristică unică: temperatura de congelare, în funcție de concentrația de diol sub 70 de grade, decât distilatul pur. Este important de remarcat faptul că această dependență neliniară, și la atingerea unui anumit glicol cantitativ începe efect opus - temperatura de congelare este crescută prin creșterea procentului solutului. Această caracteristică a fost aplicată în domeniul producerii de diferite antigeluri, lichide care nu îngheau, care cristalizează la caracteristici termice extrem de scăzute ale mediului.
Cu excepția apei, procesul de dizolvare are loc perfect în alcool și acetonă, dar nu se observă în parafină, benzen, eter și tetraclorură de carbon. Spre deosebire de alifatic său strămoș - o substanță gazoasă, cum ar fi etilen glicol, etilen glicol - este un sirop, translucid, cu o ușoară nuanță de lichid galben, gust dulceag, cu miros necaracteristic, practic nevolatilă. Congelarea are loc la o sută la sută etilenglicol - 12,6 grade Celsius, iar fierberea - la 197,8. În condiții normale, densitatea este de 1,11 g / cm3.
Metode de obținere
Etilenglicolul poate fi obținut în mai multe moduri, unele dintre ele având astăzi doar valoare istorică sau preparativă, în timp ce altele sunt folosite în mod activ de om la scară industrială și nu numai. Urmând ordinea cronologică, ia în considerare cele mai importante.
Prima metodă de obținere a etilenglicolului din dibrometan a fost deja descrisă mai sus. Formula etilenei, a cărei dublă legătură este ruptă, iar valențele libere sunt ocupate de halogeni, - materia primă principală în această reacție - pe lângă carbon și hidrogen, are în compoziție doi atomi de brom. Formarea unui intermediar în prima etapă a procedeului este posibilă tocmai datorită clivajului lor, adică înlocuirea cu grupe acetat, care după hidroliză se transformă în alcool.
Pe parcursul dezvoltării ulterioare a științei a devenit posibilă producerea etilenglicol prin hidroliză directă a oricăror etani substituiți cu doi halogeni la atomii de carbon adiacenți, cu soluții apoase de carbonați ai metalelor alcaline sau gruparea (mai puțin reactiv ecologic) H2O și dioxid de plumb. Reaction mai degrabă „laborios“ și se produce temperaturi si presiuni doar mult mai mari, dar acest lucru nu a împiedicat pe germani în timpul perioadelor războaie mondiale utilizează această metodă pentru producerea de etilenă într-o scară industrială.
Rolul său în dezvoltarea chimiei organice a fost jucat de metoda de obținere a etilenglicolului din etilen clorhidrină prin hidroliza sa cu săruri de cărbune ale metalelor de grupare alcalină. Cu o creștere a temperaturii de reacție la 170 de grade, randamentul produsului dorit a ajuns la 90%. Dar a existat un dezavantaj semnificativ - glicolul necesar pentru a fi cumva extras din soluția de sare, care implică direct o serie de dificultăți. Oamenii de știință au rezolvat această problemă dezvoltând o metodă cu aceeași substanță inițială, dar au rupt procesul în două etape.
Hidroliza etilenglikolatsetatov, fiind etapa finală a metodei anterior Wurtz, a devenit un mod separat, când este capabil să primească oxidarea materiei prime a etilenei la acid acetic cu oxigen, adică fără utilizarea de costisitoare și nu compuși halogenați nu inofensiv.
Există de asemenea multe moduri de a produce etilen glicol prin oxidarea etilenei cu hidroperoxizi, peroxizi, peracizi organici în prezența catalizatorilor (compuși osmiu) clorat de potasiu și altele. Există, de asemenea, metode electrochimice și radiații chimice.
Caracterizarea proprietăților chimice generale
Proprietățile chimice ale etilenglicolului sunt determinate de grupele sale funcționale. Un substituent hidroxil sau ambii pot participa la reacții, în funcție de condițiile de proces. Principala diferență în reactivitate constă în faptul că, datorită prezenței mai multor hidroxili în alcoolul polihidric și influența lor reciprocă, cea mai puternică proprietăți acide, decât în "colegii" monatomici. Prin urmare, în reacțiile cu produsele alcaline sunt sărurile (pentru glicol - glicolați, pentru glicerol - glicerați).
Proprietățile chimice ale etilenglicol precum și glicerol, reacția alcoolilor include toate categoriile de monohidroxilici. Glicol dă esteri complete și parțiale în reacțiile cu acizii monobazici, glicolaților, respectiv, sunt formate cu metale alcaline și cu un proces chimic cu acizi puternici sau săruri ale acidului acetic aldehidă a acesteia, eliberată - datorită clivajului moleculelor dintr-un atom de hidrogen.
Reacții cu metale active
Interacțiunea etilenglicolului cu metalele active (în picioare după hidrogen în intervalul de tensiune chimică) la temperaturi ridicate dă etilenglicolatul metalului corespunzător, plus hidrogenul este eliberat.
C2H4(OH)2 + X → C2H4oh2X, unde X este un metal divalent activ.
Reacție calitativă pe etilen glicol
Distingeți alcoolul polihidric din orice alt lichid prin utilizarea unei reacții vizuale, caracteristică numai pentru această clasă de compuși. Pentru aceasta, apa proaspăt precipitată este turnată într-o soluție de alcool incoloră hidroxid de cupru (2), care are o nuanță albastră caracteristică. Atunci când componentele mixte interacționează, se observă dizolvarea precipitatului și soluția este colorată într-o culoare albastră saturată - ca rezultat al formării glicolatului de cupru (2).
polimerizare
Proprietățile chimice ale etilenglicolului sunt importante pentru producerea de solvenți. deshidratarea intermolecular substanței menționat, și anume eliminarea apei din fiecare dintre cele două molecule de glicol și apoi combinarea (o grupare hidroxil este scindat complet, dar pe de altă parte se extinde doar hidrogen), dă posibilitatea obținerii unui solvent organic unic - dioxan, care este adesea utilizat în chimia organică, în ciuda toxicității ridicate.
Schimbul de hidroxil pentru halogen
Atunci când etilenglicolul reacționează cu acizii hidrohalici, grupările hidroxil sunt înlocuite cu halogenul corespunzător. Gradul de substituție depinde de concentrația molară a halogenurii de hidrogen din amestecul de reacție:
HO-CH2-CH2-OH + 2H> H-CH2-CH2-X, în care X este clor sau brom.
Prepararea eterilor
În reacțiile de etilenă cu acid azotic (concentrație definită) și acizi organici monobazici (formic, acetic, propionic, carnaval, valerianic și t. D.) Formarea complexului și, în consecință, monoeteri. Pentru alte concentrații de acid azotic - di- și trinitroefirov glicol. Catalizatorul este acid sulfuric cu o concentrație dată.
Derivații cei mai importanți ai etilenglicolului
Substanțe valoroase care pot fi obținute din alcooli polihidrici cu ajutorul unor simple reacții chimice (descrise mai sus) sunt eteri ai etilenglicolului. Anume: monometil și monoetil, ale căror formule sunt HO-CH2-CH2-O-CH3 și HO-CH2-CH2-O-C2H5 respectiv. Prin proprietățile chimice, ele sunt similare în multe privințe cu glicolii, dar, ca orice altă clasă de compuși, au particularități de reacție unice care sunt unice pentru ele:
- Monometiletilenglikol este lichid, fără culoare, dar cu miros dezgustător caracteristic, fierbe la 124,6 grade Celsius, bine dizolvarea în etanol și alți solvenți organici și apă sunt mult mai volatile decât glicol, și o densitate mai mică decât cea a apei (aproximativ 0,965 g / cm3).
- Dimetiletilenglicolul este, de asemenea, un lichid, dar cu un miros mai puțin caracteristic, o densitate de 0,935 g / cm3, punctul de fierbere este de 134 de grade peste zero și solubilitate comparabilă cu omologul anterior.
Utilizarea de cellosolves - așa numiți în general monoetheri ai etilenglicolului - este destul de comună. Ele sunt utilizate ca reactivi și solvenți în sinteza organică. Aplicați-le, de asemenea proprietățile fizice pentru aditivii anti-coroziune și anti-cristalizare în uleiurile antigel și motor.
Domenii de aplicare și politica prețurilor liniei de producție
Costul în fabricile și întreprinderile implicate în producerea și vânzarea unor astfel de reactivi fluctuează în medie cu aproximativ 100 de ruble pe kilogram dintr-un compus chimic, cum ar fi etilenglicolul. Prețul depinde de puritatea substanței și de procentul maxim al produsului țintă.
Utilizarea etilenglicolului nu se limitează la o singură zonă. Prin urmare, ca materie primă se utilizează în producția de solvenți organici, rășini și fibre artificiale, lichide care se îngheață la temperaturi negative. Este implicat în multe sectoare industriale, cum ar fi automobile, aviație, farmaceutică, electrică, piele, tutun. Importanța sa pentru sinteza organică este fără îndoială semnificativă.
Este important să ne amintim că glicolului - un compus toxic care poate provoca daune ireparabile pentru sănătatea umană. Prin urmare, este depozitat în recipiente etanșe, realizate din aluminiu sau oțel cu strat interior opțional protejează rezervorul împotriva coroziunii, numai în pozițiile verticale și zone care nu sunt prevăzute cu sisteme de încălzire, dar cu o bună ventilație. Termen - nu mai mult de cinci ani.
 Etilenoxid: producție, utilizare
Etilenoxid: producție, utilizare Producția industrială de etilen glicol
Producția industrială de etilen glicol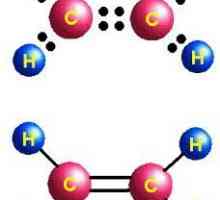 Primul reprezentant al alkenelor este etilenă. Proprietățile fizice, producția, aplicarea etilenei
Primul reprezentant al alkenelor este etilenă. Proprietățile fizice, producția, aplicarea etilenei Propilen glicol - ce este? Proprietăți chimice, aplicare
Propilen glicol - ce este? Proprietăți chimice, aplicare Hidroxid de potasiu. Obținerea, folosind, proprietățile
Hidroxid de potasiu. Obținerea, folosind, proprietățile Punctul de fierbere al alcoolului
Punctul de fierbere al alcoolului Proprietățile fizice și chimice ale grăsimilor. Recepția grăsimilor și proprietățile lor chimice
Proprietățile fizice și chimice ale grăsimilor. Recepția grăsimilor și proprietățile lor chimice Propilenglicol și glicerină: comparație și rău
Propilenglicol și glicerină: comparație și rău Proprietati chimice ale alcoolilor
Proprietati chimice ale alcoolilor Deshidratarea alcoolilor
Deshidratarea alcoolilor Alcool etilic: informații generale, metode de preparare și aplicare
Alcool etilic: informații generale, metode de preparare și aplicare Eteri. trăsătură
Eteri. trăsătură Alcooli polihidrici: caracterizare, producție și utilizare
Alcooli polihidrici: caracterizare, producție și utilizare Alcool benzilic: proprietăți, producție, aplicare
Alcool benzilic: proprietăți, producție, aplicare Descompunerea permanganatului de potasiu. Proprietăți ale sărurilor de acid manganos
Descompunerea permanganatului de potasiu. Proprietăți ale sărurilor de acid manganos Esteri: proprietăți chimice și aplicații
Esteri: proprietăți chimice și aplicații Compuși care conțin oxigen: exemple, proprietăți, formule
Compuși care conțin oxigen: exemple, proprietăți, formule Reacția calitativă la glicerină este specifică, ajutând la detectarea acesteia
Reacția calitativă la glicerină este specifică, ajutând la detectarea acesteia Alcooli monohidrici, proprietățile lor fizice și chimice
Alcooli monohidrici, proprietățile lor fizice și chimice Antigelul roșu și celelalte tipuri ale acestuia
Antigelul roșu și celelalte tipuri ale acestuia Obținerea de alcooli: metode și materii prime
Obținerea de alcooli: metode și materii prime
 Producția industrială de etilen glicol
Producția industrială de etilen glicol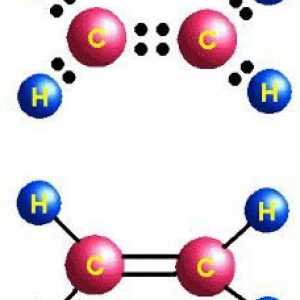 Primul reprezentant al alkenelor este etilenă. Proprietățile fizice, producția, aplicarea etilenei
Primul reprezentant al alkenelor este etilenă. Proprietățile fizice, producția, aplicarea etilenei Propilen glicol - ce este? Proprietăți chimice, aplicare
Propilen glicol - ce este? Proprietăți chimice, aplicare Proprietățile fizice și chimice ale grăsimilor. Recepția grăsimilor și proprietățile lor chimice
Proprietățile fizice și chimice ale grăsimilor. Recepția grăsimilor și proprietățile lor chimice Propilenglicol și glicerină: comparație și rău
Propilenglicol și glicerină: comparație și rău