Deshidratarea alcoolilor
Termenul "deshidratare" este utilizat în medicină (adică deshidratarea corpului); în aviație (aceasta este pierderea apei cu avionul în timpul zborului), în chimie (reacția, ca urmare a faptului că apa este separată de molecula de materie organică). Reacția de deshidratare a alcoolilor este caracteristică compușilor denumiți anterior alcool. Procesul are loc când este încălzit în prezența agenților de îndepărtare a apei, care sunt acid sulfuric, zinc clorură, aluminiu oxid sau acid fosforic. În funcție de condițiile de reacție, se pot forma hidrocarburi sau eteri nesaturați și se subîmpărțesc în mod corespunzător în deshidratare intramoleculară și intermoleculară.
eteri se formează atunci când reacția se desfășoară la o temperatură mai scăzută și un exces de alcool. În prima etapă, se obține un ester de acid sulfuric: C2H5OH + HO-S02H harr-C2H5O-S20H + H20. acidul etilsulfuric Dacă amestecul de reacție este apoi încălzit, apoi format reacționează cu un exces de alcool: C2H5O-SO2OH + C2H5OH → C2H5O-C2H5 + H2SO4. Ca rezultat, se obține eter dietil (sau sulf). Conform acestei scheme, deshidratarea intermoleculară a alcoolilor continuă. Ca rezultat, prin separarea alcoolului din două molecule de doi atomi de hidrogen și un atom de oxigen (care formează o moleculă de apă) eteri formați. În industrie, eterul dietilic este produs prin trecerea perechilor de alcool pe alumină la o temperatură de 250 ° C. Schema de reacție este după cum urmează: 2C2H5-OH-C2H5-O-C2H5 + H20.
Dehidratarea intramoleculară a alcoolilor poate avea loc numai la temperaturi mai ridicate. În acest caz, dintr-o moleculă de alcool (mai degrabă decât din două, ca în cazul precedent), molecula de apă se separă și între cei doi atomi de carbon se formează o dublă legătură. Această metodă este utilizată pentru a produce hidrocarburi nesaturate. Numai alcoolii monohidrici sunt utilizați în acest scop. De exemplu, îndepărtarea apei din alcoolul etilic are loc la o temperatură de 500 ° C deasupra catalizatorului de îndepărtare a apei, de exemplu, oxidul de aluminiu Al2O3 sau clorura de zinc ZnCI2.
Deshidratarea alcoolilor este o modalitate simplă de obținere a alchenelor gazoase în condiții de laborator. Este folosit pentru pentru producerea de etilenă din etanol: CH3-CH2-OH-> CH2 = CH2 + H2O. Deshidratarea poate avea loc în prezența unui catalizator, care este alumina. Vaporii de alcool etilic sunt trecuți peste pulberea de oxid de aluminiu încălzită. Apa separată sub formă de abur este absorbită, în timp ce etilenă pură este eliberată. Ca catalizator al acestui procedeu, pot fi utilizați acizi concentrați, de exemplu sulfurici sau fosforici. Ele, ca și oxidul de aluminiu, au proprietăți de îndepărtare a apei. Cu toate acestea, deoarece acidul sulfuric este, de asemenea, un agent oxidant puternic, ea produce o mulțime de produse secundare (de exemplu, un alcool este oxidat la bioxid de carbon și acidul redus la bioxid de sulf), astfel încât gazul produs necesită o purificare suplimentară.
Deshidratarea alcoolilor ciclici, de exemplu, deshidratarea ciclohexanolului, poate avea loc în prezența acidului fosforic. Este adesea preferat să se utilizeze acid sulfuric, deoarece, având proprietăți bune de îndepărtare a apei, este mai puțin favorabil formării de produse secundare și, de asemenea, mai sigur. Ca urmare a acestei reacții, se formează ciclohexen. Faptul că atomii de carbon sunt combinați într-un inel nu modifică chimia reacției: C6H11-OH → C6H10 + H2O. Ciclohexanolul este încălzit cu acid fosforic (V) concentrat. Hidrocarbura ciclică rezultată cu o legătură dublă în inel este o substanță lichidă, deci este distilată pentru a îndepărta impuritățile.
De asemenea, este posibil să se deshidrateze în moleculă alcooli conținând mai multe grupări hidroxil. Ca exemplu pentru alcoolii polihidroxilici pot lua în considerare rezultatele reacției în eliminarea a două molecule de apă din două molecule de etilen glicol, formând astfel un eter ciclic, dioxan: 2OH-CH2-CH2-OH → (C2H4) 2. Deshidratarea are loc în timpul distilării etilenglicolului în prezența acidului sulfuric. Aceasta este una dintre tehnologiile industriale de producere a dioxanului.
Astfel, se poate spune că deshidratarea alcoolilor are atât aplicații industriale cât și de laborator. Ca rezultat, se formează compuși chimici, care sunt utilizați pentru cercetare, dar și ca materii prime sau substanțe chimice auxiliare pentru producția chimică.
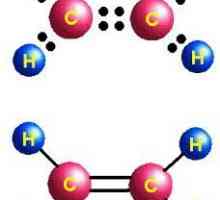 Primul reprezentant al alkenelor este etilenă. Proprietățile fizice, producția, aplicarea etilenei
Primul reprezentant al alkenelor este etilenă. Proprietățile fizice, producția, aplicarea etilenei Acid sulfuric diluat
Acid sulfuric diluat Interacțiunea acizilor cu metale. Interacțiunea acidului sulfuric cu metalele
Interacțiunea acizilor cu metale. Interacțiunea acidului sulfuric cu metalele Metode de producere a alchenelor: laborator și industrial
Metode de producere a alchenelor: laborator și industrial Nitrarea toluenului: ecuația de reacție
Nitrarea toluenului: ecuația de reacție Reacția interacțiunii dintre CaCl2, H2SO4
Reacția interacțiunii dintre CaCl2, H2SO4 Acid clorhidric
Acid clorhidric Acid acetic
Acid acetic Tipuri de reacții chimice
Tipuri de reacții chimice Proprietati chimice ale alcoolilor
Proprietati chimice ale alcoolilor Alcool etilic: informații generale, metode de preparare și aplicare
Alcool etilic: informații generale, metode de preparare și aplicare Esteri: caracteristici generale și aplicare
Esteri: caracteristici generale și aplicare Acid oxizi: o scurtă descriere a grupului
Acid oxizi: o scurtă descriere a grupului Oxizi amfoterici. Proprietăți chimice, metoda de producție
Oxizi amfoterici. Proprietăți chimice, metoda de producție Acid sulfuric. Proprietăți chimice, producție
Acid sulfuric. Proprietăți chimice, producție Acid hidrobromic. Metode de preparare, proprietăți fizice și chimice
Acid hidrobromic. Metode de preparare, proprietăți fizice și chimice Acid sulfuric. Proprietăți fizice și chimice. cerere
Acid sulfuric. Proprietăți fizice și chimice. cerere Hidroxid de magneziu. Proprietăți fizice și chimice. Aplicație.
Hidroxid de magneziu. Proprietăți fizice și chimice. Aplicație. Proprietati chimice ale acizilor
Proprietati chimice ale acizilor Proprietăți chimice ale alchenelor (olefine)
Proprietăți chimice ale alchenelor (olefine) Alcooli monohidrici, proprietățile lor fizice și chimice
Alcooli monohidrici, proprietățile lor fizice și chimice
 Interacțiunea acizilor cu metale. Interacțiunea acidului sulfuric cu metalele
Interacțiunea acizilor cu metale. Interacțiunea acidului sulfuric cu metalele Metode de producere a alchenelor: laborator și industrial
Metode de producere a alchenelor: laborator și industrial Nitrarea toluenului: ecuația de reacție
Nitrarea toluenului: ecuația de reacție Reacția interacțiunii dintre CaCl2, H2SO4
Reacția interacțiunii dintre CaCl2, H2SO4