Primul reprezentant al alkenelor este etilenă. Proprietățile fizice, producția, aplicarea etilenei
Un reprezentant luminos al hidrocarburilor nesaturate este etilenă (etilenă). Proprietăți fizice: gaz incolor incolor, exploziv într-un amestec cu oxigen și aer. Cele mai importante cantități de etilenă din petrol obținută pentru sinteza ulterioară a substanțelor organice (monohidroxilici și dihidroxilici alcooli, polimeri de acid acetic și alți compuși).
conținut
Seria de omologie etilenă, sp2-hibridizare

Hidrocarburile, similare în structură și proprietăți cu ethenom, sunt numite alkenuri. Din punct de vedere istoric, un alt termen pentru acest grup, olefine, a fost fixat. Formula generală CnH2n reflectă compoziția întregii clase de substanțe. Primul său reprezentant este etilenă, în molecula a cărei atomi de carbon nu formează trei, ci numai două legături cu hidrogen. Alkenes - compuși nesaturați sau nesaturați, formula lor C2H4. Numai norii de 2 p și 1 s electroni ai atomului de carbon sunt amestecați în formă și energie, în total trei legături x sunt formate. Această stare este numită sp2-hibridizare. A patra valență de carbon este conservată, pi - conexiune. În formula structurală, caracteristica structurală este reflectată. Dar simbolurile pentru desemnarea diferitelor tipuri de comunicare pe circuite sunt de obicei utilizate aceleași - liniuțe sau puncte. Structura etilenei determină interacțiunea sa activă cu substanțe din diferite clase. Adaosul de apă și alte particule se datorează ruperii unui fragil pi - conexiune. Valențele eliberate sunt saturate datorită electronilor de oxigen, hidrogen, halogeni.
Etilena: proprietăți fizice ale substanței
Etene în condiții normale (presiune atmosferică normală și temperatură de 18 ° C) este un gaz incolor. Ea are un miros dulce (eteric), inhalarea lui exercită un efect narcotic asupra unei persoane. Se întărește la -169,5 ° C, se topește în aceleași condiții de temperatură. Etanul se fierbe la -103,8 ° C Se aprinde atunci când este încălzit la 540 ° C. Gazul arde bine, flacăra strălucește, cu funingine slabă. Etilena se dizolvă în eter și acetonă, cu mult mai puțin în apă și alcool. Masa molară rotunjită a substanței este de 28 g / mol. Al treilea și al patrulea reprezentant al seriei omoloage de etină sunt, de asemenea, substanțe gazoase. Proprietățile fizice ale celei de-a cincea și ale următoarelor alkenuri diferă, ele sunt lichide și solide.
Pregătirea și proprietățile etilenei
Chimistul german Johann Becher a folosit accidental alcool etilic în experimente cu acid sulfuric concentrat. Aceasta a fost prima dată când a fost obținută în condiții de laborator (1680). La mijlocul secolului XIX, A.M. Butlerov a dat compusului numele de etilenă. Proprietăți fizice și reacții chimice au fost descrise de un chimist renumit rusesc. Butlerov a propus o formulă structurală care să reflecte structura materiei. Metode de obținere a acesteia în laborator:

- Hidrogenarea catalitică a acetilenei.
- Dehidrohalogenarea cloretanului în reacție cu o soluție alcoolică concentrată de bază puternică (alcalină) la încălzire.
- Desprinderea apei din moleculele de etil alcool (deshidratare). Reacția are loc în prezența acidului sulfuric. Ecuația sa este: H2C-CH2-OH → H2C = CH2 + H2O
Producția industrială:
- prelucrarea țițeiului - cracarea și piroliza materiilor prime din hidrocarburi;
- dehidrogenarea etanului în prezența unui catalizator. H3C-CH3 → H2C = CH2 + H2
Structura etilenă explică reacțiile sale chimice tipice - adaosul de particule de atomi de C, care sunt la o legătură multiplă:
- Halogenație și hidro-halogenare. Produsele acestor reacții sunt derivați halogenați.
- Hidrogenarea (saturație hidrogen), obținându-se etan.
- Oxidarea la etilenglicolul alcoolului dietilic. Formula sa: OH-H2C-CH2-OH.
- Polimerizare în conformitate cu schema: n (H2C = CH2) → n (-H2C-CH2-).


Aplicații de etilenă
În fracțional distilarea uleiului în volume mari se obține etilenă. Proprietățile fizice, structura chimică și natura materialului permite utilizarea sa în producerea de etanol, alcooli halogenați, oxid, acid acetic și alți compuși. Etilenă este un monomer de polietilenă, precum și compusul de pornire pentru polistiren.
Dicloretanul, obținut din etilenă și clor, este un bun solvent utilizat în producția de PVC (PVC). Polietilena de joasa si inalta presiune este realizata din folie, tevi, vase, polistiren - CD-uri si alte detalii. PVC este baza de linoleum, impermeabile impermeabile. În agricultură, ethenom tratează fructele înainte de recoltare pentru a accelera maturarea.
 Alcadiene: proprietăți fizice, proprietăți chimice și aplicarea lor. Proprietățile fizice ale…
Alcadiene: proprietăți fizice, proprietăți chimice și aplicarea lor. Proprietățile fizice ale… Formula benzenului: care dintre variante este corectă?
Formula benzenului: care dintre variante este corectă? Clasificarea substanțelor organice - baza pentru studiul chimiei organice
Clasificarea substanțelor organice - baza pentru studiul chimiei organice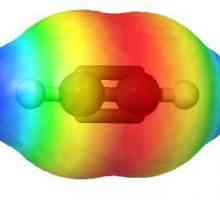 Formula structurală și moleculară: acetilenă
Formula structurală și moleculară: acetilenă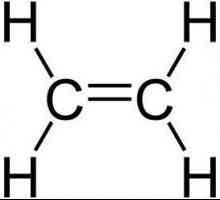 Aplicarea etilenei. Proprietățile etilenei
Aplicarea etilenei. Proprietățile etilenei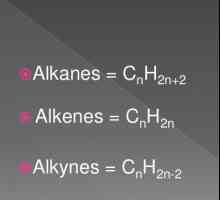 Formula generală a alchenelor. Proprietățile și caracteristicile alkenelor
Formula generală a alchenelor. Proprietățile și caracteristicile alkenelor Reacții calitative la alchene. Proprietăți chimice și structura alchenelor
Reacții calitative la alchene. Proprietăți chimice și structura alchenelor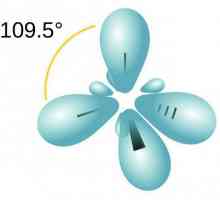 Să vorbim despre cum să determinăm tipul de hibridizare
Să vorbim despre cum să determinăm tipul de hibridizare Sunt hidrocarburile alifatice?
Sunt hidrocarburile alifatice? Producția de etilena
Producția de etilena Proprietati chimice ale alcoolilor
Proprietati chimice ale alcoolilor Hidrocarburi limită: caracteristici generale, izomerie, proprietăți chimice
Hidrocarburi limită: caracteristici generale, izomerie, proprietăți chimice Seria de omologie
Seria de omologie Deshidratarea alcoolilor
Deshidratarea alcoolilor Diene hidrocarburi: structura, izomerismul și nomenclatura
Diene hidrocarburi: structura, izomerismul și nomenclatura Compuși heterociclici: nomenclatură și clasificare
Compuși heterociclici: nomenclatură și clasificare Hidrocarburi nesaturate: alcene, proprietăți chimice și aplicații
Hidrocarburi nesaturate: alcene, proprietăți chimice și aplicații Producția de metan în condiții de acasă și de laborator
Producția de metan în condiții de acasă și de laborator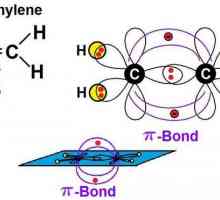 Alkenes: formula. Proprietăți chimice. recepție
Alkenes: formula. Proprietăți chimice. recepție Alcooli monohidrici, proprietățile lor fizice și chimice
Alcooli monohidrici, proprietățile lor fizice și chimice Formula structurală este o reprezentare grafică a unei substanțe
Formula structurală este o reprezentare grafică a unei substanțe
 Formula benzenului: care dintre variante este corectă?
Formula benzenului: care dintre variante este corectă?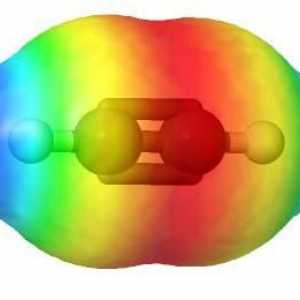 Formula structurală și moleculară: acetilenă
Formula structurală și moleculară: acetilenă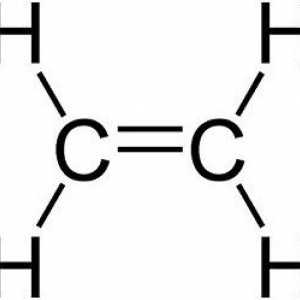 Aplicarea etilenei. Proprietățile etilenei
Aplicarea etilenei. Proprietățile etilenei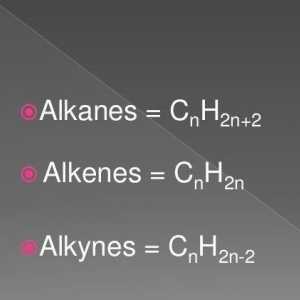 Formula generală a alchenelor. Proprietățile și caracteristicile alkenelor
Formula generală a alchenelor. Proprietățile și caracteristicile alkenelor Reacții calitative la alchene. Proprietăți chimice și structura alchenelor
Reacții calitative la alchene. Proprietăți chimice și structura alchenelor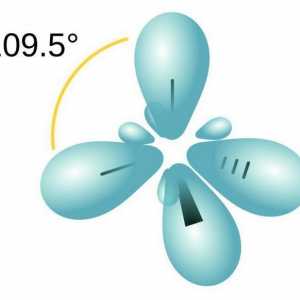 Să vorbim despre cum să determinăm tipul de hibridizare
Să vorbim despre cum să determinăm tipul de hibridizare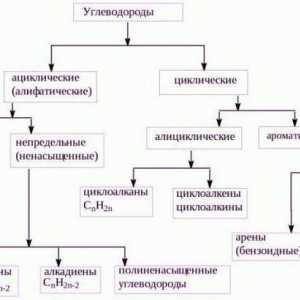 Sunt hidrocarburile alifatice?
Sunt hidrocarburile alifatice?