Atomul din chimie este ... Modelul atomului. Structura atomului
Gândurile privind esența întregului mediu au început să viziteze omenirea cu mult înainte de înflorirea civilizației moderne. La început, oamenii s-au gândit la existența unor forțe mai înalte, care, cred ei, au determinat toate ființele. Dar foarte curând filosofii și clericii au început să se gândească la ceea ce, de fapt, este chiar structura acestei ființe. Au existat multe teorii, dar din punct de vedere istoric, cel atomic a devenit dominant.
conținut
- Fondatorul teoriei atomice
- Cum a motivat democratul?
- De la democritus la concepte moderne
- Doctrina lui d. i. mendeleiev
- Descoperirea lui dalton
- Experimentarea confirmării divizibilității atomilor
- Stafide și budinci
- Experimentele curie
- Abordare "planetară"
- La ce concluzii a venit rutherford?
- Paradoxurile teoriei
- Doctrina lui bohr
- Posterate de bora
- Modelul atomului niels bohr
- Teoria cuantică a structurii atomice
- Fondatorii mecanicii cuantice
- Câteva concluzii
- Conceptul modern al structurii atomului
 Ce este un atom în chimie? Acest lucru, precum și toate subiectele conexe, vom discuta în cadrul acestui articol. Sperăm că veți găsi răspunsuri la toate întrebările din cadrul dvs.
Ce este un atom în chimie? Acest lucru, precum și toate subiectele conexe, vom discuta în cadrul acestui articol. Sperăm că veți găsi răspunsuri la toate întrebările din cadrul dvs.
Fondatorul teoriei atomice
Unde începe prima lecție de chimie? Structura atomului este tema principală. Probabil că vă amintiți că cuvântul "atom" este tradus din limba greacă veche ca fiind "indivizibil". Acum, mulți istorici cred că primul care a prezentat o teorie care spunea despre unele dintre cele mai mici particule, dintre care totul este compus, Democritus. A trăit în secolul al V-lea î.Hr.
Pentru cel mai mare regret, practic nu se știe nimic despre acest gânditor remarcabil. Nici o singură sursă scrisă din acele vremuri nu ne-a atins. Prin urmare, trebuie să învățăm despre ideile celui mai mare om de știință din epoca noastră exclusiv din lucrările lui Aristotel, Platon și alți gânditori greci antice.
Deci, tema noastră este "Structura atomului". În chimie, nu toți aveau note mari, dar mulți își amintesc că toate concluziile învățării antice au fost construite numai pe baza unor concluzii. Democritus nu a fost o excepție.
Cum a motivat democratul?
Logica sa a fost extrem de simplă, dar în același timp strălucitoare. Imaginați-vă că aveți cel mai ascuțit cuțit din întreaga lume. Iei un măr, de exemplu, și apoi începe să-l taie: două jumătăți în sferturi, împărțiți-le din nou ... Într-un cuvânt, mai devreme sau mai târziu vei primi o felii slaba de grosime care continuă să le împartă vor fi deja imposibil. Acesta va fi un atom indivizibil. În chimie, această afirmație a fost considerată adevărată aproape înainte de sfârșitul secolului al XIX-lea.
De la Democritus la concepte moderne
Trebuie remarcat faptul că doar cuvântul "atom" a supraviețuit din noțiunile antice grecești ale microproiectului. Acum, fiecare elev știe că lumea din jurul nostru constă din particule mult mai fundamentale și mai mici. Mai mult, din punctul de vedere al științei moderne, teoria lui Democritus nu a fost decât o compilație pur ipotetică, nefiind susținută deloc de dovezi. Cu toate acestea, în acele zile nu au existat microscoape electronice, astfel încât să-și dovedească cazul în alte moduri, gânditorul ar eșua încă.
Primele suspiciuni conform cărora Democritus are dreptate, au apărut în chimisti. Ei au descoperit rapid că multe substanțe se descompun în componente mai simple în timpul reacțiilor. În plus, chimiștii au dedus legile stricte ale acestor procese. Deci, ei au observat că pentru producția de apă, opt fracțiuni de masă de oxigen și un hidrogen (Legea lui Avogadro).
În Evul Mediu, orice învățătură materialistă, inclusiv teoria lui Democritus, propagare și dezvoltare nu a putut fi obținută în principiu. Și numai în secolul al XVIII-lea, oamenii de știință se întorc din nou la teoria atomică. Până când chimistul Lavoisier, marele nostru Lomonosov și talentat fizicianul englez D. Dalton (pe care le vom discuta separat), au demonstrat în mod convingător la colegii lor realitatea atomilor. Ar trebui subliniat faptul că, chiar și în teoria atomică din secolul al 18-lea luminat pentru o lungă perioadă de timp mai multe minți restante din acea vreme serios luate în considerare.
Oricare ar fi fost, dar chiar și acești oameni de știință măreți nu au prezentat încă teorii cu privire la structura atomului însuși, deoarece a fost considerată o particulă unică și indivizibilă, baza tuturor lucrurilor.
Din păcate, experimentele chimice nu au putut demonstra în mod clar realitatea transformării atomilor anumitor substanțe în altele. Dar totuși, chimia a fost știința fundamentală în studierea structurii atomilor. Atomii și moleculele au fost studiate de mult timp de un om de știință strălucit rus, fără de care nu se poate imagina știința modernă.
Doctrina lui D. I. Mendeleiev
 Un rol imens în dezvoltarea învățării atomice a jucat DI Mendeleyev, care în 1869 a creat sistemul său periodic genial. Pentru prima dată, comunitatea științifică a fost prezentată cu o teorie care nu numai că nu a respins, ci a completat în mod rezonabil toate ipotezele materialiste. Deja în secolul al XIX-lea, oamenii de știință au reușit să demonstreze existența electronilor. Toate aceste concluzii au condus la mintea cea mai bună a secolului XX pentru a studia serios atomul. În chimie, acest timp a fost marcat și de o serie de descoperiri.
Un rol imens în dezvoltarea învățării atomice a jucat DI Mendeleyev, care în 1869 a creat sistemul său periodic genial. Pentru prima dată, comunitatea științifică a fost prezentată cu o teorie care nu numai că nu a respins, ci a completat în mod rezonabil toate ipotezele materialiste. Deja în secolul al XIX-lea, oamenii de știință au reușit să demonstreze existența electronilor. Toate aceste concluzii au condus la mintea cea mai bună a secolului XX pentru a studia serios atomul. În chimie, acest timp a fost marcat și de o serie de descoperiri.
Dar învățătura lui Mendeleyev este valoroasă nu numai pentru acest lucru. Până în prezent, rămâne neclar cum s-au format atomii de diferite elemente chimice. Dar marele om de știință rus a reușit să demonstreze convingător că toți, fără excepție, sunt strâns legați între ei.
Descoperirea lui Dalton
Dar pentru a putea interpreta mai multe date disparate a fost posibil numai John Dalton, al cărui nume este imprimat pentru totdeauna într-o lege deschisă de el însuși. De obicei, omul de știință studia doar comportamentul gazelor, dar interesele sale erau mult mai largi. În 1808 a început să publice noua sa lucrare fundamentală.
Dalton a sugerat că fiecare element chimic corespunde unui anumit atom. Dar omul de știință, ca și Democritul de mai multe secole înaintea lui, încă credea că sunt complet indivizibile. În proiectele sale o mulțime de desene schematice, în care atomii sunt prezentați sub formă de bile simple. Această idee, care a apărut cu mai bine de 2500 de ani în urmă, a existat aproape la timpul nostru! Cu toate acestea, doar foarte recent a fost descoperită o structură foarte profundă a atomului. Chimia (clasa a IX-a în particular) chiar și astăzi este în mare măsură ghidată de idei care au fost exprimate pentru prima dată în secolul al XVIII-lea.
Experimentarea confirmării divizibilității atomilor
Cu toate acestea, până la sfârșitul secolului al XIX-lea, aproape toți oamenii de știință au crezut că atomul - limita dincolo de care nu există nimic. Ei au crezut că baza întregului univers este el. Acest lucru a fost facilitat de o varietate de experimente: orice s-ar putea spune, dar ceea ce se schimbă este doar molecula, in timp ce rata cu atomii de substanță nu a avut loc absolut nimic, care nu au putut fi explicate pur și simplu chimie. Structura atomului de carbon, de exemplu, rămâne complet neschimbată chiar și în diferite state alotropice.
Pe scurt, pentru o lungă perioadă de timp nu existau absolut date experimentale, care, cel puțin indirect, au confirmat suspiciunile anumitor oameni de știință că există particule mai fundamentale. Numai în secolul al XIX-lea (nu în ultimul rând datorită experimentelor cuplului Curie) sa dovedit că, în anumite condiții, atomii anumitor elemente pot fi transformate în altele. Aceste descoperiri au constituit baza ideilor moderne despre lumea din jurul nostru.
Stafide și budinci
În 1897, J. Thomson, fizician englez, a descoperit că în orice atom există o anumită cantitate de particule încărcate negativ, pe care el le numește "electroni". Deja în 1904, omul de știință a creat primul model atomic, care este mai bine cunoscut sub numele de "budincă cu stafide". Numele reflectă cu acuratețe esența. Judecând după teoria lui Thomson, un atom din chimie este un fel de "vas" cu o încărcătură distribuită uniform și electroni în el.
Rețineți că un astfel de model a circulat chiar și în secolul al XX-lea. Mai târziu sa dovedit că se înșeală complet. Dar totuși a fost prima încercare conștientă a unui om (și pe o bază științifică) de a recrea microcosmosul din jur, oferind un model atomic simplu și simplu.
Experimentele Curie
Se crede, în general, că perechea Pierre și Maria Curie a pus bazele fizicii atomice. Desigur, contribuția acestor oameni străluciți, care au sacrificat efectiv sănătatea și viața lor, nu poate fi subestimată, însă experimentele lor aveau o importanță mult mai fundamentală. Aproape simultan cu Rutherford au demonstrat că atomul este o structură mult mai complexă și mai eterogenă. Foarte fenomenul de radioactivitate, pe care l-au explorat, este tocmai ceea ce a spus acest lucru.
 Deja la începutul anului 1898 Maria a publicat primul articol dedicat radiației. În curând Maria și Pierre Curie au demonstrat că în amestecul de compuși de clorură de uraniu și radium au început să apară alte substanțe, în existența cărora chimia oficială sa îndoit. De atunci, structura atomului a început să fie investigată îndeaproape.
Deja la începutul anului 1898 Maria a publicat primul articol dedicat radiației. În curând Maria și Pierre Curie au demonstrat că în amestecul de compuși de clorură de uraniu și radium au început să apară alte substanțe, în existența cărora chimia oficială sa îndoit. De atunci, structura atomului a început să fie investigată îndeaproape.
Abordare "planetară"
În cele din urmă, Rutherford a decis să bombardeze atomii de metale grele particule alfa (heliu complet ionizat). Omul de știință a presupus imediat că electronii de lumină nu pot schimba în nici un fel traiectoria de mișcare a particulelor. În consecință, împrăștierea poate provoca numai unele elemente mai grele care pot fi conținute în nucleul atomului. Rețineți că, inițial, Rutherford nu sa prefăcut că schimba teoria "budincă". Acest model al atomului a fost considerat ireparabil.
Rezultatul, atunci când aproape toate particulele au trecut printr-un strat subțire de argint fără probleme, nu l-au surprins. Dar, în curând, a devenit clar că unii atomi de heliu au fost deflectați imediat cu 30 °. Nu era deloc ceea ce chimia vorbea atunci. Compoziția atomului conform lui Thomson a presupus o distribuție uniformă a electronilor. Dar acest lucru a fost clar contrazis de fenomenele observate.
Extrem de rare, dar încă unele particule au zburat cu un unghi chiar de 180 °. Rutherford se afla în cea mai profundă perplexitate. La urma urmei, acest lucru a contrazis brusc "budinca", sarcina în care ar fi trebuit să fie (conform teoriei lui Thomson) repartizată uniform. În consecință, secțiunile încărcate inegal care ar putea respinge heliul ionizat ar fi trebuit să fie absente.
La ce concluzii a venit Rutherford?
Aceste circumstanțe i-au determinat pe om de știință să creadă că atomul este practic gol și numai în centru există o formă de formare cu o sarcină pozitivă - nucleul. Așa a fost modelul planetar al atomului, ale căror postulete sunt după cum urmează:
- Așa cum am spus deja, în partea centrală nucleul este localizat, iar volumul său (relativ la mărimea atomului însuși) este neglijabil.
- Aproape întreaga masă atomică, precum și întreaga sarcină pozitivă, se află în nucleu.
- Electronii se rotesc în jurul lor. Este important ca numărul lor să fie egal cu valoarea taxei pozitive.
Paradoxurile teoriei
 Totul ar fi bine, dar acest model de atom nu explică în vreun fel stabilitatea lor incredibilă. Ar trebui să ne amintim că electronii se mișcă în orbitele lor cu o accelerație uriașă. Conform tuturor legilor electrodinamicii, un astfel de obiect ar trebui să-și piardă sarcina cu timpul. Dacă țineți cont de postulatele lui Newton și Maxwell, atunci electronii ar trebui să fie turnați în general în miez, ca grindina la pământ.
Totul ar fi bine, dar acest model de atom nu explică în vreun fel stabilitatea lor incredibilă. Ar trebui să ne amintim că electronii se mișcă în orbitele lor cu o accelerație uriașă. Conform tuturor legilor electrodinamicii, un astfel de obiect ar trebui să-și piardă sarcina cu timpul. Dacă țineți cont de postulatele lui Newton și Maxwell, atunci electronii ar trebui să fie turnați în general în miez, ca grindina la pământ.
Desigur, nu se întâmplă nimic în realitate. Orice atom este nu numai complet stabil, dar poate fi absolut nelimitat timp, și nici o radiație din ea nu va merge. Această discrepanță se datorează faptului că încercăm să aplicăm legi în microproiectele care sunt valabile numai în ceea ce privește mecanica clasică. Ei, așa cum sa dovedit, sunt complet inaplicabile fenomenelor de scară atomică. Și din cauza structurii atomului (chimie, clasa 11), autorii manualelor încearcă să explice cât mai simplu posibil cuvintele simple.
Doctrina lui Bohr
fizicianul danez Niels Bohr a fost dovedit că în microcosmosul nu poate fi supus acelorași legi, dispozițiile care sunt valabile pentru obiecte macroscopice. A fost ideea lui că microcosmosul „ghidat“ exclusiv de legile cuantice. Desigur, atunci nu a existat nici o teorie cuantică în sine, dar Bor a început de fapt strămoșul ei, exprimându-și gândurile lor sub forma a trei postulate care „salvat“ atomul, ar ucis în mod inevitabil, dacă el a „trăit“, conform teoriei lui Rutherford. Această teorie a Danei a constituit baza tuturor mecanicii cuantice.
Posterate de Bora
- Primul dintre ei spune: orice sistem atomic poate fi numai în stări atomice speciale, iar pentru fiecare dintre ele o anumită valoare a energiei (E) este caracteristică. Dacă starea atomului este staționară (calm), atunci nu poate radia.
- Al doilea postulat spune că emisia de energie lumină are loc numai în cazul trecerii de la o stare cu o energie mai mare la una mai moderată. În consecință, energia eliberată este egală cu diferența de valori dintre două stări staționare.
Modelul atomului Niels Bohr
Această teorie semiclastică a fost propusă de om de știință în 1913. Este demn de remarcat faptul că sa bazat pe modelul planetar al lui Rutherford, care la scurt timp înainte a descris atomul materiei. Am spus deja că calcule clasice de mecanica Rutherford contrare: pe baza acesteia, sa presupus că, cu timpul electronul a fost sigur să cadă pe suprafața atomului.
Pentru a "obține" această contradicție, omul de știință a introdus o presupunere specială. Esența sa a fost aceea că pentru a emite energie (care ar trebui să ducă la căderea lor), electronii se pot deplasa numai pe anumite orbite specifice. În timp ce le-am mutat pe alte traiectorii, presupuși atomi chimici au rămas într-o stare pasivă. Potrivit teoriei lui Bohr, acele orbite erau cele ale căror impulsuri cantitative erau egale cu constantele lui Planck.
Teoria cuantică a structurii atomice
 Așa cum am spus deja, teoria cuantică a structurii atomului este în curs de desfășurare. Chimia din ultimii ani se ghidează exclusiv de ea. Se bazează pe patru axiome fundamentale.
Așa cum am spus deja, teoria cuantică a structurii atomului este în curs de desfășurare. Chimia din ultimii ani se ghidează exclusiv de ea. Se bazează pe patru axiome fundamentale.
1. În primul rând, dualitatea (natura valului corpuscular) a electronului în sine. Pur și simplu, această particulă se comportă ca un obiect material (corpuscul), și ca un val. Ca particule, are o anumită încărcătură și o masă. Abilitatea la difracție este legată de electroni cu unde clasice. Lungimea acestui val (lambda) și viteza particulei (v) pot fi legate între ele printr-o relație specială de Broglie: lambda- = h / mv. Așa cum ați putea ghici, m este masa electronului în sine.
2. Este absolut imposibil să se măsoare coordonatele și viteza unei particule cu precizie absolută. Cu cât coordonatele sunt mai precise, cu atât este mai mare incertitudinea în viteză. Cu toate acestea, și invers. Acest fenomen a fost numit incertitudinea lui Heisenberg, care poate fi exprimată ca relație următoare: Δx ∙ m ∙ Δv> Ń / 2. Delta X (Δx) exprimă incertitudinea poziției coordonatei în spațiu. În consecință, delta V (Δv) afișează erorile de viteză.
3. Spre deosebire de toate opiniile predominante, electronii nu trec pe orbite strict definite, cum ar fi trenurile pe șine. Teoria cuantică spune că un electron poate fi oriunde în spațiu, dar probabilitatea acestui lucru este diferită pentru fiecare segment.
Acea parte a spațiului din jurul nucleului atomic însuși, în care această probabilitate este maximă, se numește orbitală. Chimia modernă studiază structura de coajă electronică a atomilor din acest punct de vedere. Desigur, școlile învață distribuția corectă a electronilor pe nivele, dar, aparent, în realitate ele diferă destul de diferit.
4. Nucleul unui atom constă din nucleoni (protoni și neutroni). Numărul de serie al unui element dintr-un sistem periodic indică numărul de protoni din nucleul său, iar suma protonilor și a neutronilor este egală cu masa atomică. Acesta este modul în care chimia modernității explică structura nucleului atomului.
Fondatorii mecanicii cuantice
 Să remarcăm acei oameni de știință care au contribuit cel mai mult la dezvoltarea unei industrii atât de importante: fizicianul francez L. de Broglie, germanul W. Heisenberg, austriacul E. Schrödinger, Engleza P. Dirac. Toți acești oameni au primit ulterior Premiul Nobel.
Să remarcăm acei oameni de știință care au contribuit cel mai mult la dezvoltarea unei industrii atât de importante: fizicianul francez L. de Broglie, germanul W. Heisenberg, austriacul E. Schrödinger, Engleza P. Dirac. Toți acești oameni au primit ulterior Premiul Nobel.
Cât de departe a trecut chimia? Structura atomului, cea mai mare parte a chimistilor din acei ani, a fost considerata destul de simpla: multi abia in 1947 au recunoscut in cele din urma realitatea existentei particulelor elementare.
Câteva concluzii
În general, crearea teoriei cuantice nu a fost lipsită de matematicieni, deoarece toate aceste procese pot fi calculate doar cu ajutorul unor calcule complexe. Dar principala dificultate nu este asta. Procesele descrise de această teorie nu sunt accesibile nu numai simțurilor noastre, în ciuda tuturor tehnicilor științifice moderne, dar și imaginației.
Nimeni nu poate nici măcar să-și imagineze procesele în microcosmos, deoarece acestea sunt complet diferite de toate acele fenomene pe care le observăm în macrocosmos. Gândiți-vă: cele mai recente descoperiri dau naștere presupunerii că există într-o dimensiune nouă dimensională (!) Quark-urile, neutrinii și alte particule fundamentale. Cum poate o persoană care trăiește într-un spațiu tridimensional să descrie cât de des comportamentul lor?
În prezent, ne putem baza doar pe matematica și puterea computerelor moderne, care, probabil, vor fi folosite pentru a modela microcosmosul. Chimia chimică ajută, de asemenea, foarte mult: structura atomului va fi cu siguranță reconsiderată, după ce, recent, oamenii de știință care lucrează în acest domeniu au raportat descoperirea unui nou tip de legătură chimică.
Conceptul modern al structurii atomului
Dacă citiți cu atenție toate cele de mai sus, atunci cu siguranță vă puteți da seama care este perspectiva actuală a structurii atomilor de substanțe. Dar totuși vom explica: aceasta este o teorie oarecum modificată a lui Rutherford, completată de postulatele neprețuite ale lui Niels Bohr. Pur și simplu, astăzi se crede că electronii se deplasează de-a lungul traiectoriilor haotice și difuze din apropierea nucleului, care constă din neutroni și protoni. Acea parte a spațiului din jurul său, în care apariția electronului este cel mai probabil, se numește orbitală.
Nu este încă posibil să spunem exact cum se vor schimba ideile noastre despre structura atomului în viitor. In fiecare zi, oamenii de știință lucrează la pătrunderea în misterele microcosmos: acceleratorului LHC (Large Hadron Collider), Premiul Nobel pentru fizica - toate acestea este rezultatul datelor anchetei.
Dar chiar și acum nu prezentăm nici măcar o imagine aproximativă a ceea ce ascund încă atomii. Este clar că atomul însuși în scara micropulturii este o clădire imensă, în care am examinat doar primul etaj și chiar și atunci nu complet. Aproape în fiecare an există rapoarte despre posibilitatea de a descoperi tot mai multe particule elementare. Când procesul de studiere a atomilor va fi complet finalizat, nimeni astăzi nu poate prezice.
 Este suficient să spunem că ideile noastre despre ele au început să se schimbe abia în 1947, când au fost descoperite așa numitele particule V. Înainte de aceasta, oamenii au adâncit doar puțin teoriile pe care se baza chimia din secolul al XIX-lea. Structura atomului este o ghicitoare fascinantă, cele mai bune minți ale omenirii sunt angajate în rezolvarea ei.
Este suficient să spunem că ideile noastre despre ele au început să se schimbe abia în 1947, când au fost descoperite așa numitele particule V. Înainte de aceasta, oamenii au adâncit doar puțin teoriile pe care se baza chimia din secolul al XIX-lea. Structura atomului este o ghicitoare fascinantă, cele mai bune minți ale omenirii sunt angajate în rezolvarea ei.
 Cum de a desena un atom: sfaturi simple
Cum de a desena un atom: sfaturi simple Structura atomului: ce este un neutron?
Structura atomului: ce este un neutron? Modele ale atomilor lui Thomson și Rutherford pentru scurt timp
Modele ale atomilor lui Thomson și Rutherford pentru scurt timp Nivelul energetic al unui atom: structura și tranzițiile
Nivelul energetic al unui atom: structura și tranzițiile Compoziția nucleului atomului. Nucleul unui atom
Compoziția nucleului atomului. Nucleul unui atom Structura atomului. Modelul cuantic-mecanic al unui atom
Structura atomului. Modelul cuantic-mecanic al unui atom Să vorbim despre cum să găsim protoni, neutroni și electroni
Să vorbim despre cum să găsim protoni, neutroni și electroni Informații de bază despre structura atomului: caracteristici, trăsături și formulă
Informații de bază despre structura atomului: caracteristici, trăsături și formulă Experimentul Rutherford privind împrăștierea particulelor alfa (pe scurt)
Experimentul Rutherford privind împrăștierea particulelor alfa (pe scurt) Structura atomului
Structura atomului Cine a propus modelul nuclear al structurii atomului? Modelul nuclear al structurii atomice și…
Cine a propus modelul nuclear al structurii atomului? Modelul nuclear al structurii atomice și… Care este diametrul unui atom? Dimensiunea atomului
Care este diametrul unui atom? Dimensiunea atomului Posterate de Bora
Posterate de Bora Încărcarea de protoni este valoarea de bază a fizicii particulelor elementare
Încărcarea de protoni este valoarea de bază a fizicii particulelor elementare Experiența lui Rutherford
Experiența lui Rutherford Ce sunt electronii de valență?
Ce sunt electronii de valență? Pe scurt despre complex: structura nucleelor de electroni ale atomilor
Pe scurt despre complex: structura nucleelor de electroni ale atomilor Structura nucleului atomic: istoria studiului și caracteristicile moderne
Structura nucleului atomic: istoria studiului și caracteristicile moderne Modelul planetar al atomului: justificarea teoretică și dovezile practice
Modelul planetar al atomului: justificarea teoretică și dovezile practice De ce constă atomul unei substanțe?
De ce constă atomul unei substanțe? Configurația electronică - secretele structurii atomului
Configurația electronică - secretele structurii atomului
 Structura atomului: ce este un neutron?
Structura atomului: ce este un neutron? Modele ale atomilor lui Thomson și Rutherford pentru scurt timp
Modele ale atomilor lui Thomson și Rutherford pentru scurt timp Nivelul energetic al unui atom: structura și tranzițiile
Nivelul energetic al unui atom: structura și tranzițiile Compoziția nucleului atomului. Nucleul unui atom
Compoziția nucleului atomului. Nucleul unui atom Structura atomului. Modelul cuantic-mecanic al unui atom
Structura atomului. Modelul cuantic-mecanic al unui atom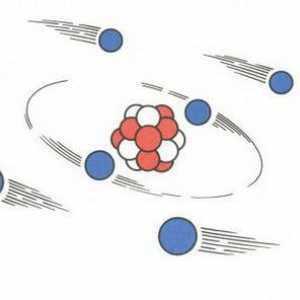 Să vorbim despre cum să găsim protoni, neutroni și electroni
Să vorbim despre cum să găsim protoni, neutroni și electroni Informații de bază despre structura atomului: caracteristici, trăsături și formulă
Informații de bază despre structura atomului: caracteristici, trăsături și formulă Experimentul Rutherford privind împrăștierea particulelor alfa (pe scurt)
Experimentul Rutherford privind împrăștierea particulelor alfa (pe scurt) Cine a propus modelul nuclear al structurii atomului? Modelul nuclear al structurii atomice și…
Cine a propus modelul nuclear al structurii atomului? Modelul nuclear al structurii atomice și…