Compoziția nucleului atomului. Nucleul unui atom
Întrebările "De ce constă materia?", "Care este natura materiei?" Întotdeauna omenirea ocupată. Din cele mai vechi timpuri, filozofii și oamenii de știință au căutat răspunsuri la aceste întrebări, creând atât teorii realiste, cât și absolut uimitoare și fantastice și ipoteze. Cu toate acestea, literalmente, în urmă cu un secol, omenirea a ajuns la soluția acestui mister cât mai aproape posibil, dezvăluind structura atomică a materiei. Dar care este compoziția nucleului atomului? Despre ce este vorba?
conținut
De la teorie la realitate
La începutul secolului al XX-lea, structura atomică a încetat să mai fie doar o ipoteză, dar a devenit un fapt absolut. Sa dovedit că compoziția nucleului atomului este un concept foarte complicat. Include încărcături electrice. Dar a apărut întrebarea: compoziția atomului și a atomului a nucleului atomic include un număr diferit de aceste taxe sau nu?

Modelul planetar
Inițial, a fost reprezentat faptul că atomul a fost construit foarte asemănător sistemului nostru solar. Cu toate acestea, sa dovedit rapid că o astfel de reprezentare nu este în întregime adevărată. Problemele de un transfer pur mecanic de imagine la scară astronomice în regiune, care ocupă milionimi de milimetru, a dus la o schimbare semnificativă și dramatică în proprietățile și calitățile fenomenelor. Principala diferență a fost legile și regulile mult mai rigide, pe care a fost construit atomul.

Dezavantaje ale modelului planetar
În primul rând, deoarece atomii din același gen și element în ceea ce privește parametrii și proprietățile trebuie să fie exact aceiași, atunci orbitele electronilor acestor atomi trebuie să fie, de asemenea, identice. Cu toate acestea, legile mișcării organelor astronomice nu au putut oferi răspunsuri la aceste întrebări. A doua contradicție este că mișcarea electronilor în orbita sa, dacă am aplica legile fizice bine studiate trebuie să fie însoțită de o eliberare permanentă de energie. Ca urmare, acest proces ar duce la epuizarea electronului, care în cele din urmă ar dispărea și chiar va cădea pe nucleu.

Structura valurilor mameiși
În 1924, tânărul aristocrat Louis de Broglie a prezentat o idee care a transformat punctele de vedere ale comunității științifice în chestiuni precum structura atomului, compoziția nucleelor atomice. Ideea era că un electron nu este doar o minge în mișcare care se rotește în jurul nucleului. Este o substanță fuzzy care se mișcă în conformitate cu legile care seamănă cu propagarea valurilor în spațiu. Destul de repede, această idee sa extins la mișcarea oricărui corp în ansamblul său, explicând că observăm o singură parte a acestei mișcări însăși, dar a doua nu se manifestă în realitate. Putem vedea propagarea valurilor și nu observăm mișcarea particulei sau invers. De fapt, ambele părți ale mișcării este întotdeauna acolo, iar rotirea electronilor în orbita sa - este nu numai mișcarea taxei, dar, de asemenea, propagarea undelor. Această abordare este fundamental diferită de modelul planetar adoptat anterior.
Baza fundamentală
Nucleul atomului este centrul. În jurul ei și rotirea electronilor. Proprietățile kernelului sunt determinate de orice altceva. A vorbi despre un astfel de concept ca compunerea nucleului unui atom este necesar din cel mai important moment - din sarcină. Un anumit număr de electroni se observă în compoziția atomului, care are o încărcătură negativă. Nucleul în sine are o încărcătură pozitivă. Din aceasta putem trage concluzii:
- Nucleul este o particulă încărcată.
- În jurul nucleului există o atmosferă pulsantă creată de încărcături.
- Este nucleul și caracteristicile sale care determină numărul de electroni din atom.
Proprietăți kernel
Cuprul, sticla, fierul, lemnul au aceiasi electroni. Un atom poate pierde o pereche de electroni sau chiar toate. Dacă nucleul rămâne încărcat pozitiv, atunci poate extrage cantitatea corectă de particule încărcate negativ de la alte corpuri, ceea ce îi va permite să supraviețuiască. Dacă un atom pierde un anumit număr de electroni, atunci sarcina pozitivă a nucleului va fi mai mare decât restul încărcărilor negative. În acest caz, întregul atom va dobândi un exces de sarcină și poate fi numit un ion pozitiv. În unele cazuri, un atom poate atrage mai mulți electroni și apoi va deveni încărcat negativ. În consecință, se poate numi un ion negativ.

Cât cântărește un atom??
Masa unui atom este determinată, în principal, de nucleu. Electronii care alcătuiesc atomul și nucleul atomic cântăresc mai puțin de o mie din masa totală. Deoarece masa este considerată o măsură a rezervei de energie pe care o posedă o substanță, acest fapt este considerat extrem de important în studierea unei astfel de întrebări ca și compoziția nucleului unui atom.
radioactivitate
Cele mai dificile întrebări au apărut după descoperire Razele X. Elementele radioactive emit valuri alfa, beta și gamma. Dar o astfel de radiație trebuie să aibă o sursă. Rutherford în 1902 a arătat că o astfel de sursă este atomul în sine sau mai curând nucleul. Pe de altă parte, radioactivitatea nu este numai emisia de raze, ci și traducerea unui element în altul, cu proprietăți chimice și fizice complet noi. Asta este, radioactivitatea este o schimbare a nucleului.
Ce știm despre structura nucleară?
Cu aproape o sută de ani în urmă fizicianul Prout a avansat ideea că elementele din sistemul periodic nu sunt forme incoerente, ci combinații atomi de hidrogen. Prin urmare, ar putea fi de așteptat ca ambele taxe și mase de nuclee să fie exprimate în termeni de sarcini întregi și multiple de hidrogen în sine. Cu toate acestea, acest lucru nu este în întregime adevărat. Prin studierea proprietăților nucleelor atomice prin intermediul câmpurilor electromagnetice, fizician Aston a constatat că elementele de greutate atomică care nu erau multipli întregi și, de fapt - o combinație de atomi diferiți, nu o singură substanță. În toate cazurile, când greutate atomică nu este un număr întreg, observăm un amestec de izotopi diferiți. Ce este? Dacă vorbim despre compoziția nucleului atomului, izotopii sunt atomi cu sarcini identice, dar cu mase diferite.

Einstein și nucleul atomului
Teoria relativității spune că masa nu este o măsură prin care se determină cantitatea de materie, ci măsura energiei care contează. În consecință, materia nu poate fi măsurată prin masă, ci prin sarcina care formează această chestiune și prin energia încărcării. Când aceeași taxă se apropie de alta, energia va crește, în caz contrar - scădere. Acest lucru, desigur, nu înseamnă o schimbare în materie. În consecință, din această poziție, nucleul unui atom nu este o sursă de energie, ci mai degrabă un reziduu după eliberare. Prin urmare, există unele contradicții.
neutronii
Curies când bombardate cu particule alfa de beriliu descoperit unele raze ciudate care intra in coliziune cu nucleul unui atom se resping cu forță mare. Cu toate acestea, ei pot trece printr-o grosime mare de materie. Această contradicție a fost rezolvată de faptul că particula dată a avut o încărcătură electrică neutră. În consecință, el a fost numit un neutron. Din cauza cercetărilor ulterioare, sa dovedit că masa de neutroni aproape la fel ca protonul. În general, neutronul și protonul sunt incredibil de asemănătoare. Luând în considerare această descoperire, era cu siguranță posibil să se stabilească faptul că protonul și neutronii intră în nucleul atomic și în cantități egale. Totul a căzut treptat. Numărul de protoni este numărul atomic. Greutatea atomică este suma masei de neutroni și protoni. Un izotop poate fi numit și un element în care numărul de neutroni și protoni nu va fi egal unul cu celălalt. După cum sa menționat deja mai sus, în acest caz, deși elementul rămâne în fapt același, proprietățile sale se pot schimba semnificativ.
 Structura atomului: ce este un neutron?
Structura atomului: ce este un neutron? Modele ale atomilor lui Thomson și Rutherford pentru scurt timp
Modele ale atomilor lui Thomson și Rutherford pentru scurt timp Nivelul energetic al unui atom: structura și tranzițiile
Nivelul energetic al unui atom: structura și tranzițiile Ce particulă elementară are o încărcătură pozitivă?
Ce particulă elementară are o încărcătură pozitivă? Modelul planetar al lui Rutherford, atom în modelul Rutherford
Modelul planetar al lui Rutherford, atom în modelul Rutherford Structura atomului. Modelul cuantic-mecanic al unui atom
Structura atomului. Modelul cuantic-mecanic al unui atom Nucleul atomic. Descoperirea unor secrete
Nucleul atomic. Descoperirea unor secrete Să vorbim despre cum să găsim protoni, neutroni și electroni
Să vorbim despre cum să găsim protoni, neutroni și electroni Experimentul Rutherford privind împrăștierea particulelor alfa (pe scurt)
Experimentul Rutherford privind împrăștierea particulelor alfa (pe scurt) Structura atomului
Structura atomului Greutatea protonului
Greutatea protonului Încărcarea de protoni este valoarea de bază a fizicii particulelor elementare
Încărcarea de protoni este valoarea de bază a fizicii particulelor elementare Experiența lui Rutherford
Experiența lui Rutherford Descoperirea unui proton și a unui neutron
Descoperirea unui proton și a unui neutron Pe scurt despre complex: structura nucleelor de electroni ale atomilor
Pe scurt despre complex: structura nucleelor de electroni ale atomilor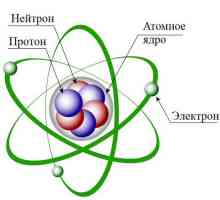 Ce depinde numărul de electroni din atom și de pe el?
Ce depinde numărul de electroni din atom și de pe el?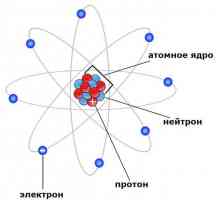 Care sunt nucleonii și ce pot fi construiți din ele?
Care sunt nucleonii și ce pot fi construiți din ele? Structura nucleului atomic: istoria studiului și caracteristicile moderne
Structura nucleului atomic: istoria studiului și caracteristicile moderne Modelul planetar al atomului: justificarea teoretică și dovezile practice
Modelul planetar al atomului: justificarea teoretică și dovezile practice De ce constă atomul unei substanțe?
De ce constă atomul unei substanțe? Configurația electronică - secretele structurii atomului
Configurația electronică - secretele structurii atomului

 Modele ale atomilor lui Thomson și Rutherford pentru scurt timp
Modele ale atomilor lui Thomson și Rutherford pentru scurt timp Nivelul energetic al unui atom: structura și tranzițiile
Nivelul energetic al unui atom: structura și tranzițiile Ce particulă elementară are o încărcătură pozitivă?
Ce particulă elementară are o încărcătură pozitivă? Modelul planetar al lui Rutherford, atom în modelul Rutherford
Modelul planetar al lui Rutherford, atom în modelul Rutherford Structura atomului. Modelul cuantic-mecanic al unui atom
Structura atomului. Modelul cuantic-mecanic al unui atom Să vorbim despre cum să găsim protoni, neutroni și electroni
Să vorbim despre cum să găsim protoni, neutroni și electroni Experimentul Rutherford privind împrăștierea particulelor alfa (pe scurt)
Experimentul Rutherford privind împrăștierea particulelor alfa (pe scurt)