Monoxid de carbon: Formula și proprietățile
Multe substanțe gazoase care există în natură și sunt produse în producție sunt compuși otrăviți puternici. Se știe că clorul a fost folosit ca armă biologică, că vaporii de brom au un efect foarte coroziv asupra pielii, hidrogen sulfurat provoacă otrăvire și așa mai departe.
conținut
O astfel de substanță este atât monoxid de carbon, cât și monoxid de carbon, a cărui formulă are propriile particularități în structură. Despre el și va merge mai departe.

Formula chimică a monoxidului de carbon
Forma empirică a formulării compusului luat în considerare este următoarea: CO. Cu toate acestea, această formă oferă doar o caracterizare a compoziției calitative și cantitative, dar nu afectează caracteristicile structurale și ordinea aderării atomilor în moleculă. Și diferă de celelalte gaze similare.
Această caracteristică afectează proprietățile fizice și chimice expuse de compus. Ce fel de structură este?
Structura moleculei
În primul rând, conform formulei empirice, se observă că valența carbonului din compus este II. La fel ca și oxigenul. În consecință, fiecare dintre ele poate forma două comunicare. chimic Formula monoxid de carbon CO demonstrează clar acest lucru.
Asta se întâmplă. Între atomul de carbon și oxigen, o legătură dublă covalentă polară se formează prin mecanismul de socializare a electronilor nepartiți. În acest fel, formula structurală monoxidul de carbon are forma C = 0.
Cu toate acestea, caracteristicile moleculare nu se termină acolo. Conform mecanismului donor-acceptor, în moleculă se formează o a treia legătură dativă sau șapte polari. Cum se explică acest lucru? De la educație legături covalente prin ordine de schimb, oxigenul rămâne două perechi de electroni, iar atomul de carbon - un orbital gol, atunci acesta din urmă acționează ca un acceptor al uneia dintre perechile primului. Cu alte cuvinte, o pereche de electroni de oxigen este plasată pe orbita liberă a carbonului și se formează o legătură.

Deci, carbonul este un acceptor, oxigenul este un donator. Prin urmare, formula de monoxid de carbon din chimie are următoarea formă: Сequiv-О. Această structurare dă moleculei stabilitate chimică suplimentară și inerție în proprietățile expuse în condiții normale.
Astfel, legăturile din molecula de monoxid de carbon:
- doi polari covalenți, formați de mecanismul de schimb datorat socializării electronilor nepartiți;
- o dativă, formată de interacțiunea donator-acceptor între o pereche de electroni și o orbitală liberă;
- există trei legături în moleculă.
Proprietăți fizice
Există o serie de caracteristici care, la fel ca orice alt compus, posedă monoxid de carbon. Formula substanței face clar faptul că rețeaua cristalină este moleculară, starea în condiții normale este gazoasă. Prin urmare, următorii parametri fizici.
- Cequiv-O - monoxid de carbon (formula), densitate - 1,164 kg / m3.
- Punctul de fierbere și punctul de topire, respectiv: 191/205 0S.
- Se dizolvă în: apă (ușor), eter, benzen, alcool, cloroform.
- Nu are gust și miros.
- Este incolor.
Din punct de vedere biologic, este extrem de periculos pentru toate ființele vii, cu excepția anumitor tipuri de bacterii.

Proprietăți chimice
Din punct de vedere al activității chimice, una dintre cele mai inerte substanțe în condiții normale este monoxidul de carbon. Formula, care reflectă toate legăturile din moleculă, confirmă acest lucru. Din cauza acestei structuri puternice, acest compus, cu parametrii de mediu standard, practic nu intră în nici o interacțiune.
Cu toate acestea, ar trebui să se încălzească cel puțin ușor sistemul, deoarece legătura dativă din moleculă se prăbușește, cum ar fi legăturile covalente. Apoi, monoxidul de carbon începe să arate proprietăți de reducere active și suficient de puternic. Deci, el este capabil să interacționeze cu:
- oxigen;
- clor;
- alcaline (topite);
- cu oxizi și săruri metalice;
- cu sulf;
- ușor cu apă;
- cu amoniac;
- cu hidrogen.
Prin urmare, după cum sa menționat deja mai sus, proprietățile pe care le prezintă monoxidul de carbon, formula sa explică în mare măsură.

Fiind în natură
Principala sursă de CO în atmosfera Pământului este incendiile forestiere. La urma urmei, principala modalitate de formare a acestui gaz este în mod natural arderea incompletă a diferitelor tipuri de combustibil, în principal de natură organică.
Sursele antropice de poluare a aerului cu monoxid de carbon sunt la fel de importante și oferă un procent masic de același procent ca și cel natural. Acestea includ:
- fumul din activitatea fabricilor și a plantelor, complexele metalurgice și alte întreprinderi industriale;
- gaze de eșapament provenite de la motoarele cu ardere internă.
În condiții naturale, monoxidul de carbon este ușor oxidat de oxigenul din aer și de vaporii de apă până la dioxidul de carbon. Aceasta este baza primului ajutor pentru otrăvirea acestui compus.

recepție
Merită să subliniem o trăsătură. Monoxidul de carbon (formula), dioxidul de carbon (structura moleculei), respectiv, arata astfel: Сequiv-О si О = С = О. Diferența este un atom de oxigen. Prin urmare, metoda industrială de producere a unui monoxid se bazează pe reacția dintre dioxid și cărbune: CO2 + C = 2CO. Aceasta este cea mai simplă și cea mai comună metodă de a sintetiza acest compus.
În laborator, diverse compuși organici, săruri de metale și substanțe complexe, deoarece randamentul produsului nu se așteaptă prea mult.
Un reactiv calitativ pentru prezența în aer sau a unei soluții de monoxid de carbon este clorura de paladiu. Atunci când interacționează, se formează un metal pur, care determină o întunecare a soluției sau a suprafeței hârtiei.

Acțiune biologică asupra corpului
După cum sa menționat deja mai sus, monoxidul de carbon este un dăunător foarte toxic, periculos și mortal pentru corpul uman. Și nu numai omul, ci, în general, orice lucru viu. Plantele care se află sub influența gazelor de eșapament ale autovehiculelor moare foarte repede.
Care este exact efectul biologic al monoxidului de carbon asupra mediului intern al animalelor? Este vorba despre formarea unor compuși puternici complexi ai proteinei hemoglobinei din sânge și a gazului în cauză. Adică, moleculele otrăvitoare sunt captate în locul oxigenului. Respirația celulară este blocată instantaneu, schimbarea gazului devine imposibilă în cursul său normal.
Ca urmare, toate moleculele de hemoglobină sunt blocate treptat și, ca o consecință, moartea. Este suficient să distrugeți doar 80%, astfel încât rezultatul otrăvirii este letal. Pentru aceasta, concentrația monoxidului de carbon din aer ar trebui să fie de 0,1%.
Primele semne pe care este posibil să se determine debutul otrăvirii prin acest compus sunt:
- dureri de cap;
- amețeli;
- pierderea conștiinței.
Primul ajutor este acela de a merge la aer proaspăt, unde monoxidul de carbon se va transforma în dioxid de carbon sub influența oxigenului, adică va fi dezumflat. Cazurile de deces cauzate de acțiunea substanței în cauză sunt foarte frecvente, în special în casele cu aragaz încălzire. La urma urmei, când se arde lemnul, cărbunele și alte tipuri de combustibil ca produs secundar, acest gaz se formează în mod necesar. Respectarea regulilor de siguranță este extrem de importantă pentru conservarea vieții și a sănătății umane.
Există, de asemenea, multe cazuri de otrăvire în spațiile de garaj, unde sunt asamblate o mulțime de motoare de mașini de lucru, dar influxul de aer proaspăt nu este suficient. Moartea care depășește concentrația admisă are loc în decurs de o oră. Pentru a simți prezența gazului este fizic imposibilă, pentru că nu există miros sau culoare.

Utilizare în industrie
În industria metalurgică, monoxidul de carbon este adesea folosit pentru reacțiile de reducere a metalelor din oxizi sau săruri ale acestora. Formula compusului rezultat este CO2. De asemenea, a format o substanță pură - metal.
În plus, se utilizează monoxid de carbon:
- pentru prelucrarea cărnii și a produselor pescărești, ceea ce le permite să ofere un aspect nou;
- pentru sinteza anumitor compuși organici;
- ca o componentă a gazului generator.
Prin urmare, această substanță nu este numai dăunătoare și periculoasă, ci și foarte utilă pentru o persoană și pentru activitățile sale economice.
 Cu ce compuși reacționează monoxidul de carbon 4? La ce substanțe reacționează dioxidul de carbon?
Cu ce compuși reacționează monoxidul de carbon 4? La ce substanțe reacționează dioxidul de carbon? Ce este monoxidul de carbon? Structura moleculei
Ce este monoxidul de carbon? Structura moleculei Ce este o substanță complexă? Cum se întâmplă?
Ce este o substanță complexă? Cum se întâmplă? Primul reprezentant al alkenelor este etilenă. Proprietățile fizice, producția, aplicarea etilenei
Primul reprezentant al alkenelor este etilenă. Proprietățile fizice, producția, aplicarea etilenei Formula benzenului: care dintre variante este corectă?
Formula benzenului: care dintre variante este corectă? Formula chimică a glicerinei. Formula structurală și moleculară
Formula chimică a glicerinei. Formula structurală și moleculară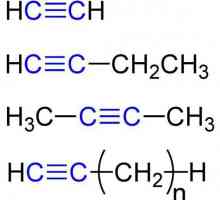 Proprietăți chimice ale alchinelor. Structura, recepția, aplicarea
Proprietăți chimice ale alchinelor. Structura, recepția, aplicarea Monoxid de carbon
Monoxid de carbon Cum se determină compoziția calitativă și cantitativă a materiei
Cum se determină compoziția calitativă și cantitativă a materiei Principalele proprietăți chimice ale dioxidului de carbon
Principalele proprietăți chimice ale dioxidului de carbon Izomerii structurali sunt ceea ce
Izomerii structurali sunt ceea ce Pentan: izomeri și nomenclatură
Pentan: izomeri și nomenclatură Compuși organici și clasificarea acestora
Compuși organici și clasificarea acestora Proprietăți chimice ale alcanilor
Proprietăți chimice ale alcanilor Hidrocarburi limită: caracteristici generale, izomerie, proprietăți chimice
Hidrocarburi limită: caracteristici generale, izomerie, proprietăți chimice Seria de omologie
Seria de omologie Dioxid de carbon. Proprietăți, producție, aplicare
Dioxid de carbon. Proprietăți, producție, aplicare Acid gazos. Formula, producția, proprietățile chimice
Acid gazos. Formula, producția, proprietățile chimice Producția de alcani și proprietățile acestora
Producția de alcani și proprietățile acestora Formula structurală este o reprezentare grafică a unei substanțe
Formula structurală este o reprezentare grafică a unei substanțe Masa moleculară relativă este o cantitate fizică specifică fiecărei substanțe
Masa moleculară relativă este o cantitate fizică specifică fiecărei substanțe
 Ce este monoxidul de carbon? Structura moleculei
Ce este monoxidul de carbon? Structura moleculei Ce este o substanță complexă? Cum se întâmplă?
Ce este o substanță complexă? Cum se întâmplă? Primul reprezentant al alkenelor este etilenă. Proprietățile fizice, producția, aplicarea etilenei
Primul reprezentant al alkenelor este etilenă. Proprietățile fizice, producția, aplicarea etilenei Formula benzenului: care dintre variante este corectă?
Formula benzenului: care dintre variante este corectă? Formula chimică a glicerinei. Formula structurală și moleculară
Formula chimică a glicerinei. Formula structurală și moleculară Proprietăți chimice ale alchinelor. Structura, recepția, aplicarea
Proprietăți chimice ale alchinelor. Structura, recepția, aplicarea Cum se determină compoziția calitativă și cantitativă a materiei
Cum se determină compoziția calitativă și cantitativă a materiei Principalele proprietăți chimice ale dioxidului de carbon
Principalele proprietăți chimice ale dioxidului de carbon Izomerii structurali sunt ceea ce
Izomerii structurali sunt ceea ce