Momentul descoperirilor științifice - principiul Pauli
Cele mai semnificative realizări ale fizicienilor din trecut, care lucrează în domeniu structura materiei pe nivelul de e-nuclear reprezentări aparțin începutul secolului trecut. Una din astfel de descoperiri în cunoașterea microworld-ului este cunoscută în istoria științei sub denumirea de "principiul Pauli". În acel moment, a devenit clar că natura cuantică a fenomenelor care au loc în interiorul atomului a schimbat în mod dramatic multe concepte despre realitățile microproceselor. Și ce este acest cuantum? Aceasta este o anumită unitate de măsură a cantității fizice sub forma "porțiunii" sale minime, care nu poate fi mai mică decât. De exemplu, raza primei orbite electronice nu poate fi mai mică de 5,29 mdot-10-11 m. Este incorect să vorbim despre distanțe mai mici decât această sumă - ele nu par a exista.
Quantum sunt concepte fizice familiare, care sunt masa, forta, energie, extinde înțelegerea naturii de electroni și alte particule care alcătuiesc atomul. Și, firește, pentru a vorbi în detaliu despre "cărămizile universului", au fost create unelte pentru descrierea lor. De atunci, starea unui electron se caracterizează prin patru numere, numite numere cuantice. Diferitele combinații ale acestor numere determină singura apariție completă și unică a oricărui electron. Odată ce a devenit posibil pentru a descrie energia, spațiul și stările interne ale electronului, pe ordinea de zi a primit următoarea întrebare - și modul în care electronii care fiecare atom poate fi mai multe, sunt situate în jurul nucleului? Cum sunt "împachetate"? Studiul acestei întrebări a condus la formularea unei legi cunoscute sub numele de principiul Pauli. Care este esența lui?
Un pic de auto-educație
1. Atomul în forma sa cea mai simplă are componentele principale - nucleul și electronii, localizați, respectiv, în centru și în orbite în jurul nucleului. Radiunile orbitelor (notate cu n) iau valorile numerelor întregi, începând cu un cuantum - porțiunea minimă posibilă a distanței. Pentru cazul în care n = 1, avem o orbită minimală "scăzută" de-a lungul căreia se rotește electronul cu cea mai mică energie. Nivelul energetic Electronul este determinat de numărul cuantic n, numit și numărul principal. Rețineți că pentru o anumită rază n, este posibil să se calculeze numărul de electroni din această orbită cu formula N = 2 (n • n). Prin urmare, este ușor să se calculeze numărul limită de electroni pe orbită cu numărul n: primul - doi, al doilea - opt, al treilea - optsprezece, etc. Această concluzie privind umplerea cochililor cu electroni într-o cantitate care nu depășește N este un punct important care conține principiul Pauli.
2. Un electron poate avea sublevels de energie pentru fiecare nivel principal. Ele sunt notate cu l, numita parte (sau orbital), numarul cuantic si poate avea o valoare de la l la 0 la 4. Valoarea l determină forma spațială a norului de electroni: sferice, dumbbell, etc.
3. Mișcarea unui electron, cu alte cuvinte, a curentului, conduce la crearea unui câmp magnetic circular. Dar în acest caz, electronul are o orbită moment magnetic, care se caracterizează prin următorul, al treilea rând, numărul cuantic ml. Se numește magnetică cuantic și este proiecția momentului unghiular orbital al electronului pe direcția câmpului magnetic. Valorile pe care le poate lua numărul ml sunt în intervalul de la -l la + l, luând în considerare valoarea zero și toate pot fi (2l + 1).
4. În cele din urmă, ultima caracteristică cuantică a unui electron este rotirea. Conține doar 2 semne ms = + 1/2 și ms = -1 / 2. Esența fizică a rotației este momentul impulsului mecanic al electronului, care nu are legătură cu mișcarea sa în spațiu.
Legătura dintre principiul Pauli și sistemul periodic Mendeleev
În 1925, în fizică, a fost făcută descoperirea proprietății fundamentale a microworld-ului, comparabilă doar cu tabelul lui DI Mendeleyev. Acesta a primit numele "nașului" său și de atunci a fost cunoscut ca principiul Pauli. Chimia ca știință despre substanțe și interacțiunile lor în cadrul sistemului periodic nu a putut explica multe dintre mecanismele proceselor care au loc în unificarea atomilor, formarea moleculelor etc. Principalul motiv a fost că nivelul de detaliu al atomului, din punctul de vedere al chimiei, a început pe conceptele de atom, electron, nucleu. Aceste reprezentări moleculare atomice au apărut și au fost înființate cu aproximativ 150 de ani în urmă - în secolul anterior. Puțin mai târziu, A.M. Butlerov a dezvoltat o teorie a compușilor chimici și apoi a fost deschisă legislația periodică. Acest lucru ne-a permis să ne imaginăm nașterea unei molecule de la atomi și a oferit o înțelegere a structurii "economiei" atomice.
Înțelegerea esenței caracteristicilor cuantice ale modelului de electroni a devenit posibilă după formularea principiului Pauli. Cu ajutorul ei, a fost explicată imaginea dispunerii cojilor și ordinea umplerii lor de electroni. Esența principiului este că electronii pot avea orice combinație a atomului patru caracteristici cuantice de mai sus, dar nu poate fi compus din doi electroni, identice în toate caracteristicile cuantice.
Principalul rezultat al descoperirii legilor structurii atomului, care conține principiul Pauli, este fizica, adică Natura fenomenului, care constă în umplerea cochiliilor cu electroni. Și aceasta, la rândul său, a dat premisele pentru fundamentarea legii periodice. Astfel, conținutul "chimic" al legilor structurii generale a atomului și moleculei a primit confirmarea sa fundamentală în fizică prin construirea "arhitecturii" interne a atomului.
 Electronii sunt ce? Proprietățile și istoria descoperirii electronilor
Electronii sunt ce? Proprietățile și istoria descoperirii electronilor Modele ale atomilor lui Thomson și Rutherford pentru scurt timp
Modele ale atomilor lui Thomson și Rutherford pentru scurt timp Modelul planetar al lui Rutherford, atom în modelul Rutherford
Modelul planetar al lui Rutherford, atom în modelul Rutherford Quantum este o realitate
Quantum este o realitate Numerele cuantice și semnificația lor fizică
Numerele cuantice și semnificația lor fizică Știința naturii este ... Tipuri de cunoaștere științifică a naturii
Știința naturii este ... Tipuri de cunoaștere științifică a naturii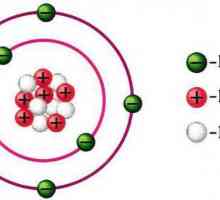 Schema structurii atomului: un nucleu, o coajă de electroni. exemple
Schema structurii atomului: un nucleu, o coajă de electroni. exemple Teoria zonelor solide. Mecanica cuantică pentru manechine
Teoria zonelor solide. Mecanica cuantică pentru manechine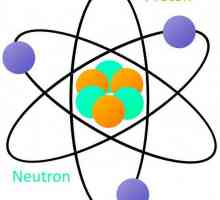 Definiția unui atom și a unei molecule. Definiția atomului până în 1932
Definiția unui atom și a unei molecule. Definiția atomului până în 1932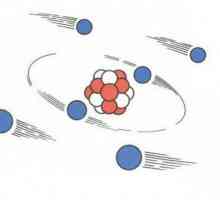 Să vorbim despre cum să găsim protoni, neutroni și electroni
Să vorbim despre cum să găsim protoni, neutroni și electroni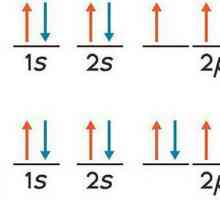 Care este configurația electronică a potasiului
Care este configurația electronică a potasiului Ce studiază fizica
Ce studiază fizica Care este diametrul unui atom? Dimensiunea atomului
Care este diametrul unui atom? Dimensiunea atomului Greutatea protonului
Greutatea protonului Fizica și revoluția științifică și tehnologică: fuziunea științei cu tehnologia
Fizica și revoluția științifică și tehnologică: fuziunea științei cu tehnologia Ce este mecanica cuantică?
Ce este mecanica cuantică? Care este starea excitat a unui atom
Care este starea excitat a unui atom Masă electronică - bobină mică și drumuri
Masă electronică - bobină mică și drumuri Conceptul de știință naturală modernă. Schiță logică și filosofică
Conceptul de știință naturală modernă. Schiță logică și filosofică Pe scurt despre complex: structura nucleelor de electroni ale atomilor
Pe scurt despre complex: structura nucleelor de electroni ale atomilor Momentul magnetic este o proprietate fundamentală a particulelor elementare
Momentul magnetic este o proprietate fundamentală a particulelor elementare
 Modele ale atomilor lui Thomson și Rutherford pentru scurt timp
Modele ale atomilor lui Thomson și Rutherford pentru scurt timp Modelul planetar al lui Rutherford, atom în modelul Rutherford
Modelul planetar al lui Rutherford, atom în modelul Rutherford Quantum este o realitate
Quantum este o realitate Numerele cuantice și semnificația lor fizică
Numerele cuantice și semnificația lor fizică Știința naturii este ... Tipuri de cunoaștere științifică a naturii
Știința naturii este ... Tipuri de cunoaștere științifică a naturii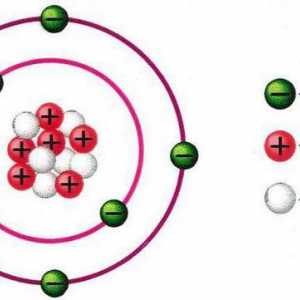 Schema structurii atomului: un nucleu, o coajă de electroni. exemple
Schema structurii atomului: un nucleu, o coajă de electroni. exemple Teoria zonelor solide. Mecanica cuantică pentru manechine
Teoria zonelor solide. Mecanica cuantică pentru manechine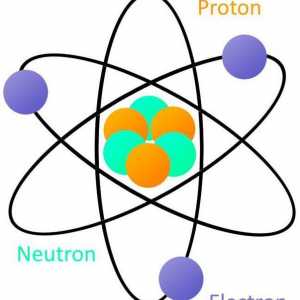 Definiția unui atom și a unei molecule. Definiția atomului până în 1932
Definiția unui atom și a unei molecule. Definiția atomului până în 1932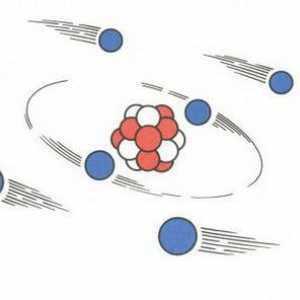 Să vorbim despre cum să găsim protoni, neutroni și electroni
Să vorbim despre cum să găsim protoni, neutroni și electroni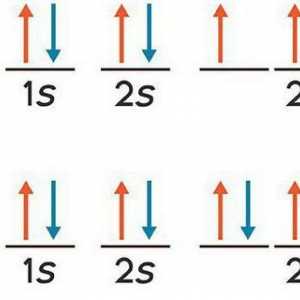 Care este configurația electronică a potasiului
Care este configurația electronică a potasiului