Starea agregată de sare de masă. Sare de masă, chimie
Mai mult de 10 milioane de compuși organici și mai mult de 500 de mii de compuși anorganici cunoscuți chimistilor până în prezent. Printre acestea există complexe în structură și proprietăți, care sunt utilizate numai în scopuri chimice sau medicale. Și există și acelea care nu sunt deloc complicate și foarte frecvente în viața de zi cu zi. Dar acest lucru nu este mai puțin important și semnificativ. Una dintre aceste substanțe este sarea de masă. În viața de zi cu zi se numește hrană, iar în industria chimică se numește clorură de sodiu sau clorură de sodiu. În industria tehnologică, se numește mineralul pe care îl formează în natură - halit, precum și sare de rocă sau sare de rocă tare. Să analizăm în detaliu starea agregată de sare de masă, structura, proprietățile, extracția, aplicarea și istoricul introducerii în consumul de masă.
conținut

În ce state există sare?
Ce este stare agregată de substanțe și cum se întâmplă? Depinde de ce substanță este implicată. Fiecare elev de clasa a VII-a poate suna starea agregată de sare de masă, deoarece aceasta este substanța care se găsește în fiecare casă. Astăzi, fără ea, este dificil pentru o persoană modernă să-și imagineze viața. În plus, starea agregată de sare de masă este destul de evidentă pentru ochiul liber - cristale mici sau mari dispersate ale formei cubice corecte. Totuși, dizolvând sarea în apă, o vom obține deja într-o altă stare agregată - lichidă. Vom obține același rezultat dacă pur și simplu topim cristalele la temperaturi ridicate. Singura condiție care nu este caracteristică pentru sare este gazoasă. Dar, în anumite condiții, o puteți obține.
Condiții de modificare a stării agregate
- Pentru a obține sarea în stare lichidă prin topirea cristalelor de origine naturală, o temperatură de 800 ° CdespreS.
- Pentru a transfera sarea în stare gazoasă, cristalele topite trebuie aduse la fierbere (aproximativ 1400 ° C)despreC) și se fierbe până la trecerea completă a componentelor structurale în ioni (Na+ și CL-).
- Starea agregată solidă de sare de masă este forma sa naturală în condiții naturale.

De ce apare o astfel de răspândire a temperaturilor atunci când manipulați cristalele? Acest lucru se explică prin structura laturii cristalului.
Dulap de cristal
Este un cristal transparent cristal transparent, centrat pe față. În fiecare colț al cubului (locurile de zăbrere) există ioni Na alternativi incarcați pozitiv+ și ionii încărcați negativ CL-. Datorită electronegativității foarte diferite a acestor atomi, există o atracție electrostatică puternică între ele încât trebuie aplicate condiții severe (temperatură înaltă, impact mecanic) pentru ao distruge. o astfel de tip de zăbrele de cristal se numește ionic și este caracteristic tuturor sărurilor metalelor alcaline, alcalino-pământoase și metalelor de tranziție.
De aceea temperatura sarei de masă (atât pentru topire cât și pentru fierbere) este atât de ridicată. Cu toate acestea, cristalele pot fi obținute nu numai în formă cubică, ci și în cristale piramidale (opt, douăsprezece și douăzeci). Pentru a face acest lucru, reglați pur și simplu temperatura de evaporare a soluției sărate într-un anumit mod. În orice caz, cavitatea interioară a cristalelor rămâne umplută cu lichid, dacă este o soluție de sare în apă.

Formula chimică a clorurii de sodiu este simplă și se exprimă prin compoziția elementară a NaCl.
Proprietățile fizice ale halitului
Proprietățile fizice ale clorurii de sodiu pot fi descrise în mai multe locuri:
- Cristale solide de alb, roz, albastru, violet, roșu. Culoarea depinde de prezența impurităților în timpul extracției. O substanță pură de culoare albă cristalină.
- Se dizolvă în apă într-un raport de aproximativ 100/30 (în 100 g apă, 30 g de sare). Solubilitatea bună se datorează prezenței dipolilor de apă care asociază ioni de sodiu și clor în jurul lor, provocând distrugerea atracției electrostatice între ele și, ca rezultat, distrugerea rețelei de cristal.
- Se topește și se fierbe la temperaturi ridicate (800-1400 ° C)despreC).
- Are un miros plăcut subtil.
- Sare pe palate.

Proprietăți chimice ale clorurii de sodiu
Ca orice sare mijlocie solubila, clorura de sodiu este capabila sa interactioneze cu:
- Alte săruri în reacția de schimb (condiție obligatorie: reacția de evoluție a gazului, precipitarea sau formarea substanței malodisocompatibil): NaCL + AgNO3 = NaNO3 + AgCL (precipitat alb brânzos). Aceasta este o reacție calitativă la ionul CL-.
- Cu metale, stând în EHRNM la stânga de sodiu: K + NaCL = KCL + Na.
- Se disociază în soluție apoasă în dipoli hidrațiali liberi de ioni de apă: NaCL (apă rr) = Na+ + CL-. Ca rezultat, se formează o soluție de sare obișnuită, care este un electrolit puternic.
- Hidroliza nu este afectată, deoarece este o sare formată dintr-un acid puternic și o bază puternică.
- În timpul electrolizei (efectul curentului electric) se descompune pentru a forma produse libere și soda caustică (caustică): NaCL = Na + Cl2 + NaOH.
Unde natura conține clorură de sodiu?
În prezent, sarea de masă este o substanță adesea găsită în natură. Și deși a fost întotdeauna așa, dar în vremuri străvechi și vremuri ale Evului Mediu a fost considerat un produs foarte scump. Toate acestea din cauza faptului că nu știau cum să extragă sarea din surse naturale. Există o mulțime de astfel de surse în rezervele mondiale - halitul este considerat o resursă naturală aproape nelimitată. Unde este sarea în natură?
- Mări și oceane cu apă sărată.
- Lacurile sărate.
- Izvoarele sărate.
- Apă subterană.
- Apele estuarelor.

Extracția halitului
Extracția și prelucrarea sarelor au o tehnologie proprie, deoarece materia minată pur și simplu nu este adecvată pentru utilizare din cauza conținutului ridicat de impurități străine. Obțineți galit diferit, de exemplu:
- de lucrări subterane;
- de la cusăturile de la baza iazurilor de sare;
- evaporarea sau înghețarea apei sărate sau oceanice;
- evaporarea apelor subterane.
Oricare dintre metode face posibilă obținerea cristalelor de halit. Cu toate acestea, pentru consumul în alimente trebuie să fie supuse unui alt tip de tratament - măcinare. La urma urmei, cu greu nimeni nu folosește acasă gătit un cristal mare de sare de masă. Cel mai adesea este achiziționat în deja purificat din impurități, zdrobit aproape sub formă de pulbere. De asemenea, există tipuri de sare iodată, fluorurate și așa mai departe, nu numai pentru alimente, ci și pentru scopuri tehnice.
Aplicarea sarii de roca
Domeniile de aplicare și utilizarea clorurii de sodiu sunt foarte extinse. Principalele, împreună cu exemplele și rezultatele, sunt prezentate în tabel.
| industrie | Bazele utilizării sarei | rezultat |
| peisaj de construcție | Îmbunătățirea solului la temperaturi scăzute și eliminarea scurgerilor de apă | Construcția canalelor de irigare și a rezervoarelor |
| medicină | Similitudinea unei soluții de sare cu sângele uman. O soluție de înlocuitor de sânge de clorură de sodiu (0,85%), numită fiziologică | Restaurarea balanței sângelui după pierderea extinsă a sângelui, normalizarea pompei de sodiu în sistemul cardiovascular, menținerea constanței compoziției sucului gastric |
| chimic | Sinteza substanțelor semnificative practic bazate pe clorură de sodiu brută | Obțineți: bicarbonat de sodiu, acid clorhidric, sodiu metalic, clor, hidroxid de sodiu, sticlă, materiale plastice, săpun, hârtie și alte produse |
| alimente | Acțiunea antiseptică și antibacteriană a sării | Conservarea produselor (carne, pește, legume), îmbunătățirea gustului produselor alimentare |
| metalurgic | Proprietățile fizice și chimice ale sării | Obtinerea de aluminiu, baterii sare, filtre |
| piele | Acțiunea antiseptică și antibacteriană a sării | Tratamentul blănurilor și al piei brute cu bronzare |
Istoria apariției în viața de zi cu zi
Sare a apărut pe mese în fiecare casă, nu imediat. Odată ce a fost evaluat în greutate de aur, și în sensul cel mai direct. Încă din secolul al XVIII-lea, unele popoare din Africa au schimbat o mână de sare pentru o mână de nisip auriu. Puțin mai târziu în Etiopia, barele de sare erau moneda standard. În Roma antică, legionarii militari au dat chiar și un salariu lunar cu această substanță, ceea ce a dus în cele din urmă la numirea soldaților lor. Copiii săraci din popoarele africane pur și simplu au lins bucățile de piatră de sare de masă ca un tratament. În Olanda, era folosit pentru a pedepsi criminali, pentru tortură. Făcătorul nu a primit sare deloc, iar persoana a murit într-un timp scurt.
Pentru prima dată să aloce și să consume această substanță pe care oamenii au învățat-o în cele mai vechi timpuri. Apoi sa constatat că sarea este conținută în plante. Prin urmare, au fost arse, iar cenușa a fost folosită ca un condiment. Mai târziu, în China, au învățat să se evapore sarea din apa de mare, iar procesul de dezvoltare a metodelor de obținere a început să se miște mai repede.

În Rusia sarea a fost extrasă din lacuri (cele mai renumite lacuri sărate Rusia este încă - Elton și Baskunchak). Apoi semnificația comercială a substanței a fost foarte rară. A fost produsă doar de câțiva negustori, care apoi au vândut la prețuri exorbitante. Numai oamenii bogați și faimoși își puteau permite să aibă sare. În timp, producția și producția s-au îmbunătățit. Au început să fie utilizate diferite metode de extracție și prelucrare, iar până în prezent una dintre cele mai comune substanțe uzuale este clorura de sodiu. Chimia acestui compus, proprietățile sale, aplicația sa în medicină și alte ramuri au devenit cunoscute aproximativ din secolele XVI-XVII.
Studiați cursul școlii
Studiul structurii și a stării agregate, precum și proprietățile chimice ale sarei de masă, începe cu banca școlară, în cadrul unei discipline precum chimia (gradul 8). Sărurile din școală sunt studiate în toată diversitatea lor în natură. Elevii obțin o idee despre baza chimică, formulele empirice, proprietățile fizice și chimice de bază. Pentru simplitatea și comoditatea amintirii formulelor și proprietățile fizice Pe foaia de lucru a manualului există de obicei săruri, masa cărora dă o idee despre solubilitatea lor în apă. Acolo găsiți informații despre solubilitatea acizilor, bazelor și alcalinilor.

O caracteristică importantă a sărurilor este fuzibilitatea lor, pe baza căreia se realizează, de asemenea, extracția lor în natură. Este ușor pentru studenți să își găsească rulmenții atunci când rezolvă problemele legate de fuzibilitatea sarelor. Tabela și imaginile grafice permit nu numai să vedeți substanța cu punct de topire scăzut sau refractară, ci și să determinați valoarea aproximativă punctul de topire și fierbere. De obicei, astfel de tabele sunt de asemenea localizate în manuale ("Chimie", clasa 8). Sărurile ar trebui studiate în contextul unor științe precum biologia și fizica. Prin urmare, multe sarcini pentru studenți sunt construite pe integrarea comunicațiilor intersubiect.
 Conexiunile binare sunt ce?
Conexiunile binare sunt ce? Ce este o substanță complexă? Cum se întâmplă?
Ce este o substanță complexă? Cum se întâmplă? Formula de sare este gătit. Formulă chimică: sare de masă. Proprietățile sarei de masă
Formula de sare este gătit. Formulă chimică: sare de masă. Proprietățile sarei de masă Cum se face o soluție salină de 10%? Uimitoare proprietati de vindecare a sarii. Tratarea sării
Cum se face o soluție salină de 10%? Uimitoare proprietati de vindecare a sarii. Tratarea sării Sare de amoniu - metode de producție, utilizare în economia națională
Sare de amoniu - metode de producție, utilizare în economia națională Sare. Bicarbonat de amoniu
Sare. Bicarbonat de amoniu Soluție izotonică
Soluție izotonică Substanțe anorganice
Substanțe anorganice Care este natura oxizilor
Care este natura oxizilor Săruri duble: exemple și nume
Săruri duble: exemple și nume Reacția interacțiunii dintre CaCl2, H2SO4
Reacția interacțiunii dintre CaCl2, H2SO4 Halit de piatră: proprietăți, descriere și domeniu de aplicare
Halit de piatră: proprietăți, descriere și domeniu de aplicare Acid clorhidric
Acid clorhidric Starea agregată a materiei
Starea agregată a materiei Hidrosulfit de sodiu. Proprietăți fizice și chimice. cerere
Hidrosulfit de sodiu. Proprietăți fizice și chimice. cerere Sare rosie
Sare rosie Sulfură de sodiu
Sulfură de sodiu Proprietăți chimice ale sărurilor și metode de preparare a acestora
Proprietăți chimice ale sărurilor și metode de preparare a acestora Substanțe anorganice: exemple și proprietăți
Substanțe anorganice: exemple și proprietăți Oxizii. Exemple, clasificare, proprietăți
Oxizii. Exemple, clasificare, proprietăți De ce moose iubesc sarea? Cauze și consecințe
De ce moose iubesc sarea? Cauze și consecințe
 Ce este o substanță complexă? Cum se întâmplă?
Ce este o substanță complexă? Cum se întâmplă? Formula de sare este gătit. Formulă chimică: sare de masă. Proprietățile sarei de masă
Formula de sare este gătit. Formulă chimică: sare de masă. Proprietățile sarei de masă Cum se face o soluție salină de 10%? Uimitoare proprietati de vindecare a sarii. Tratarea sării
Cum se face o soluție salină de 10%? Uimitoare proprietati de vindecare a sarii. Tratarea sării Care este natura oxizilor
Care este natura oxizilor Săruri duble: exemple și nume
Săruri duble: exemple și nume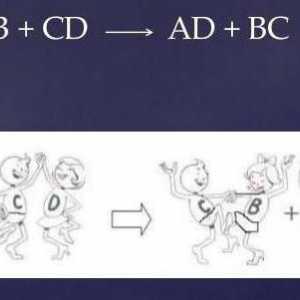 Reacția interacțiunii dintre CaCl2, H2SO4
Reacția interacțiunii dintre CaCl2, H2SO4