Formula de oxigen. Tabelul periodic al lui Mendeleev - oxigen
conținut
- Chalcogene sunt legate de elementele de oxigen
- Oxigenul este elementul cel mai comun
- Structura atomului de oxigen
- Proprietățile oxigenului - un element chimic
- Oxigenul este o substanță simplă
- Proprietăți fizice
- Obținerea oxigenului în laborator
- Ardere
- Producția de oxigen la scară industrială
- Calcularea chimică prin formula și ecuațiile de reacție care implică moleculele o2
- Rolul moleculelor o2 în natură și în viața umană
- Oxigenul este un oxidant ideal
Chalcogene sunt legate de elementele de oxigen
Atomii asemănători sunt un grup în sistemul periodic. Oxigenul conduce familia de chalcogene, dar diferă de acestea într-o serie de proprietăți.

Masa atomică de oxigen - strămoșul grupului - este de 16 a. Calculele în formarea compușilor cu hidrogen și metale prezintă starea lor obișnuită de oxidare: -2. De exemplu, în apă (H2О) numărul de oxigenare al oxigenului este -2.
Compoziția compușilor tipici de hidrogen ai căldogenilor corespunde formulei generale: H2R. Atunci când aceste substanțe sunt dizolvate, se formează acizi. Numai compusul hidrogen al oxigenului-apă are proprietăți speciale. Potrivit oamenilor de știință, această substanță neobișnuită este un acid foarte slab și o bază foarte slabă.

Sulful, seleniul și telurul au stări pozitive de oxidare pozitivă (+4, +6) în compușii cu oxigen și alte metale nemetalice cu electronegativitate ridicată (EO). Compoziția oxizilor de căldură reflectă formulele generale: RO2, RO3. Acizii corespunzători au compoziția: H2RO3, H2RO4.
Elementele corespund unor substanțe simple: oxigen, sulf, seleniu, telur și poloniu. Primii trei reprezentanți prezintă proprietăți nemetalice. Formula de oxigen este O2. Modificarea alotropică a aceluiași element este ozonul (O3). Ambele modificări sunt gaze. Sulful și seleniul sunt nemetale solide. Telurul este o substanță metaloidă, conductoare de curent electric, poloniul este un metal.
Oxigenul este elementul cel mai comun
Conținutul total de atomi elementari din scoarța pământului este de aproximativ 47% (în greutate). Oxigenul se găsește atât într-o formă liberă, cât și în compoziția a numeroși compuși. O substanță simplă a cărei formulă este O2, este situat în atmosferă, reprezentând 21% din aer (în volum). Oxigenul oxigen este dizolvat în apă, localizat între particulele de sol.
Știm deja că există un alt fel de existență a aceluiași element chimic sub forma unei substanțe simple. Acest ozon este un gaz care formează la o înălțime de aproximativ 30 km de la suprafața pământului un strat, denumit adesea un ecran de ozon. Oxigenul legat intră în moleculele de apă, în multe roci și minerale, compuși organici.

Structura atomului de oxigen
Tabelul periodic al lui Mendeleev conține informații complete despre oxigen:
- Numărul de serie al elementului este 8.
- Încărcarea de bază este +8.
- Numărul total de electroni este de 8.
- Formula electronică de oxigen este de 1 s22s22p4.
În natură, există trei izotopi stabili care au același număr ordinal în tabelul periodic, aceeași compoziție de protoni și electroni, dar un număr diferit de neutroni. Izotopii sunt notați cu același simbol, O. Pentru comparație, să dăm o diagramă care să reflecte compoziția celor trei izotopi ai oxigenului:

Proprietățile oxigenului - un element chimic
La substratul 2p al atomului, există doi electroni nepartiți, ceea ce explică apariția stărilor de oxidare -2 și +2. Doi electroni perechi nu pot fi deconectați, astfel încât gradul de oxidare crește până la +4, ca și în sulf și alte calcinoizi. Motivul este absența unei suprafețe libere. Prin urmare, în compuși, elementul chimic oxigen nu prezintă un grad de valență și oxidare egal cu numărul grupului în versiunea scurtă a sistemului periodic (6). Numărul oxidativ uzual este -2.
Numai în compușii cu fluor, oxigenul prezintă o stare de oxidare pozitivă non-caracteristică de +2. Valoarea EO a două concentrații diferite de nemetale: EA (D) = 3.5 EE (F) = 4. Ca element mai electronegative, fluor mai puternic retine electronii de valență și atrage particulele la un nivel de energie externă a atomului de oxigen. Prin urmare, în reacția cu fluor, oxigenul este un agent de reducere, dă electronii.

Oxigenul este o substanță simplă
Exploratorul englez D. Priestley în 1774, în timpul experimentelor, a izolat gazul în descompunerea oxidului de mercur. Cu doi ani mai devreme, K. Sheele a primit aceeași substanță în forma ei pură. Doar cativa ani mai tarziu, chimistul francez A. Lavoisier a stabilit ca pentru gaz este parte din aer, a studiat proprietatile. Formula chimică a oxigenului este O2. Noi reflectăm în înregistrarea compoziției substanței electronii care participă la formarea unei legături covalente nepolare - O :: O. Să înlocuim fiecare pereche de legături electronice cu o singură linie: 0 = 0. Această formulă de oxigen arată clar că atomii din moleculă sunt conectați între două perechi comune de electroni.

Realizăm calcule simple și determinăm care este masa moleculară relativă a oxigenului: Mr (O2) = Ar (O) x 2 = 16 x 2 = 32. Pentru comparație: Mr (air) = 29. Formula chimică pentru oxigen diferă de formula ozonului de către un atom de oxigen. Prin urmare, domnul (O3) = Ar (O) x 3 = 48. Ozonul este de 1,5 ori mai greu decât oxigenul.
Proprietăți fizice
Oxigenul este un gaz fără culoare, gust și miros (la temperatură obișnuită și presiune atmosferică). Substanța este ușor mai greu decât aerul, se dizolvă în apă, dar în cantități mici. Punctul de topire al oxigenului este o valoare negativă și este -218,3 ° C. Momentul în care oxigenul lichid devine din nou gazos este punctul său de fierbere. Pentru moleculele O2 valoarea acestei cantități fizice atinge -182,96 ° C. În stare lichidă și solidă, oxigenul are o culoare albastru deschis.
Obținerea oxigenului în laborator
Când substanțele conținând oxigen, cum ar fi permanganatul de potasiu sunt încălzite, se eliberează un gaz incolor, care poate fi colectat într-un balon sau într-un tub de testare. Dacă aduceți oxigenului pur un fascicul luminat, atunci acesta arde mai puternic decât în aer. Două alte metode de laborator pentru obținerea oxigenului - descompunerea peroxidului de hidrogen și a cloratului de potasiu (sare de berthollet). Să luăm în considerare schema aparatului, care este folosită pentru descompunerea termică.

Într-un tub de testare sau într-un balon cu fund rotund este necesar să se toarnă un pic de sare Bertholet, închideți dopul cu un tub de evacuare a gazului. Capătul opus trebuie trimis (sub apă) în balonul cu capul în jos. Gâtul trebuie să fie coborât într-un pahar sau într-un cristalizor plin cu apă. Când tubul de test cu sare Bertolet este încălzit, se eliberează oxigen. Pe conducta de gaz intră în balon, dând apă din el. Când balonul este umplut cu gaz, acesta este închis cu un dop sub apă și răsturnat. Oxigenul obținut în acest experiment de laborator poate fi folosit pentru a studia proprietățile chimice ale unei substanțe simple.
ardere
Dacă laboratorul arde substanțe în oxigen, atunci trebuie să știți și să respectați reglementările privind incendiile. Hidrogenul arde instantaneu în aer și amestecat cu oxigen într-un raport de 2: 1, este exploziv. Combustia de substanțe în oxigen pur are loc mult mai intens decât în aer. Acest fenomen este explicat prin compoziție aer. Oxigenul din atmosferă este puțin mai mult de 1/5 din parte (21%). Combustia este reacția substanțelor cu oxigen, ca urmare a formării diferitelor produse, în principal a oxizilor de metale și nemetalici. Incendii periculoase O2 cu substanțe combustibile, în plus, compușii care rezultă pot fi toxici.
Arderea unei lumânări convenționale (sau potrivire) este însoțită de formarea de dioxid de carbon. Următoarea experiență poate fi efectuată acasă. Dacă arzi o substanță sub un borcan de sticlă sau un pahar mare, arderea se va opri de îndată ce se va consuma tot oxigenul. Azotul nu susține respirația și arderea. Dioxidul de carbon, un produs de oxidare, nu mai reacționează cu oxigenul. transparent apă caldă permite detectarea prezenței dioxid de carbon dupa arderea lumanarilor. Dacă treci produsele de ardere prin hidroxid de calciu, soluția devine tulbure. Există o reacție chimică între apa calcaroasă și dioxidul de carbon, rezultând carbonat de calciu insolubil.

Producția de oxigen la scară industrială
Cel mai ieftin proces, care are ca rezultat moleculele libere de aer, O2, nu este legată de comportamentul reacțiilor chimice. În industrie, să zicem, la fabricile metalurgice, aerul la temperatură scăzută și presiunea ridicată este lichefiat. Astfel de componente importante ale atmosferei, ca azot și oxigen, se fierbe la temperaturi diferite. Se separă amestecul de aer cu încălzire treptată până la temperatura normală. Mai întâi, moleculele de azot sunt separate, apoi oxigenul. Metoda de separare se bazează pe proprietăți fizice diferite ale substanțelor simple. Formula pentru materia simplă de oxigen este aceeași ca și înainte de răcirea și aerul lichefiat, - O2.
Ca urmare a unor reacții de electroliză, de asemenea, este eliberat oxigenul, acesta fiind colectat deasupra electrodului corespunzător. Gazul este necesar de către companiile industriale, de construcții în volume mari. Nevoia de oxigen este în continuă creștere, în special industria chimică are nevoie de ea. Gazul obținut este depozitat în scopuri industriale și medicale în butelii de oțel echipate cu marcare. Capacitățile cu oxigen sunt vopsite în albastru sau albastru pentru a le distinge de alte gaze lichefiate - azot, metan, amoniac.

Calcularea chimică prin formula și ecuațiile de reacție care implică moleculele O2
Valoarea numerică a masei moleculare de oxigen coincide cu o altă valoare - masa moleculară relativă. Numai în primul caz există unități de măsură. Pe scurt, formula pentru substanța oxigenului și masa molară a acestuia trebuie să fie scrisă după cum urmează: M (O2) = 32 g / mol. În condiții normale, mă rog ca orice gaz să corespundă unui volum de 22,4 litri. Prin urmare, 1 mol O2 Are 22,4 litri de substanță, 2 mol O2 - 44,8 litri. Prin ecuația reacției dintre oxigen și hidrogen, se poate observa că 2 moli de hidrogen și 1 mol de oxigen interacționează:

Dacă 1 mol de hidrogen participă la reacție, volumul de oxigen va fi de 0,5 mol • 22,4 l / mol = 11,2 l.
Rolul moleculelor O2 în natură și în viața umană
Oxigenul este consumat de organisme vii de pe Pământ și participă la circulația substanțelor peste 3 miliarde de ani. Aceasta este principala substanță pentru respirație și metabolism, ajută la descompunerea moleculelor de nutrienți, sintetizează energia necesară pentru organisme. Oxigenul este consumat în mod constant pe Pământ, dar stocurile sale sunt reumplete datorită fotosintezei. Omul de știință rus K. Timiryazev a crezut că datorită acestui proces, există încă viață pe planeta noastră.

Rolul oxigenului în natură și economie este mare:
- este absorbit în procesul de respirație de către organisme vii;
- participă la reacțiile de fotosinteză în plante;
- face parte din moleculele organice;
- procesele de degradare, fermentare, rugină apar cu participarea oxigenului, care acționează ca oxidant;
- Se utilizează pentru obținerea unor produse valoroase de sinteză organică.
Oxigenul lichefiat în cilindri este utilizat pentru tăierea și sudarea metalelor la temperaturi ridicate. Aceste procese se desfășoară la uzinele de construcții de mașini, transport și construcții. Pentru a efectua munca sub apă, subteran, la altitudine mare într-un spațiu fără aer, oamenii au nevoie și de molecule O2. Perne de oxigen Acestea sunt folosite în medicină pentru a îmbogăți compoziția aerului inhalat de bolnavi. Gazul pentru scopuri medicale diferă de lipsa tehnică aproape totală a impurităților străine, a mirosului.

Oxigenul este un oxidant ideal
Compușii de oxigen cu toate elementele chimice ale tabelului periodic sunt cunoscuți, cu excepția primilor reprezentanți ai familiei de gaze nobile. Multe substanțe reacționează direct cu atomii de O, excluzând halogeni, aur și platină. O mare importanță sunt fenomenele care implică oxigen, care sunt însoțite de eliberarea luminii și a căldurii. Astfel de procese sunt utilizate pe scară largă în viața de zi cu zi, în industrie. În metalurgie, interacțiunea dintre minereuri și oxigen este numită prăjire. Minele pre-zdrobite sunt amestecate cu aer îmbogățit cu oxigen. La temperaturi ridicate, metalele sunt recuperate de la sulfuri la substanțe simple. Deci, obțineți fier și unele metale neferoase. Prezența oxigenului pur crește viteza proceselor tehnologice din diferite ramuri ale chimiei, ingineriei și metalurgiei.
Apariția unei metode ieftine de obținere a oxigenului din aer prin metoda de separare în componente la temperaturi scăzute a stimulat dezvoltarea multor domenii de producție industrială. Chimiștii consideră moleculele O2 și atomi de O cu agenți de oxidare ideali. Acestea sunt materiale naturale, ele sunt în mod constant reînnoite în natură, nu poluează mediul. În plus, reacțiile chimice care implică oxigen conduc cel mai adesea la sinteza unui alt produs natural și sigur - apă. Rolul lui O2 în neutralizarea deșeurilor industriale toxice, purificarea apei din poluare. În plus față de oxigen, modificarea alotropică - ozonul - este utilizată pentru dezinfecție. Această substanță simplă are o activitate oxidantă ridicată. Când ozonizează apa, poluanții se descompun. Ozonul are, de asemenea, un efect dăunător asupra microflorei patogene.
 Molecule de hidrogen: diametru, formulă, structură. Care este masa moleculei de hidrogen?
Molecule de hidrogen: diametru, formulă, structură. Care este masa moleculei de hidrogen? Sistemul periodic al lui Mendeleev. Elementele chimice ale tabelului periodic
Sistemul periodic al lui Mendeleev. Elementele chimice ale tabelului periodic Care este valența sulfului? Posibile valențe de sulf
Care este valența sulfului? Posibile valențe de sulf Modificări alotropice ale oxigenului: caracteristică și valoare comparativă
Modificări alotropice ale oxigenului: caracteristică și valoare comparativă Determinați valența elementelor chimice
Determinați valența elementelor chimice Proprietățile fizice ale aldehidelor
Proprietățile fizice ale aldehidelor Masa moleculară a oxigenului. Care este masa molară de oxigen?
Masa moleculară a oxigenului. Care este masa molară de oxigen?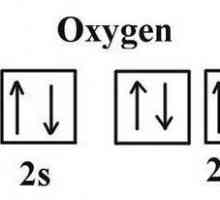 Care este valența de oxigen în compuși?
Care este valența de oxigen în compuși? Sistem periodic: clasificarea elementelor chimice
Sistem periodic: clasificarea elementelor chimice Cum se compune o ecuație chimică: reguli, exemple. Înregistrarea reacției chimice
Cum se compune o ecuație chimică: reguli, exemple. Înregistrarea reacției chimice Cum se determină compoziția calitativă și cantitativă a materiei
Cum se determină compoziția calitativă și cantitativă a materiei Sistemul periodic al lui Mendeleev și legea periodică
Sistemul periodic al lui Mendeleev și legea periodică Non-metalele sunt ...? Proprietăți ale metalelor
Non-metalele sunt ...? Proprietăți ale metalelor 115 Element al tabelului periodic: caracteristic
115 Element al tabelului periodic: caracteristic Oxid de vanadiu: formule, proprietăți
Oxid de vanadiu: formule, proprietăți Legea periodică
Legea periodică Proprietățile chimice și fizice, aplicarea și producerea oxigenului
Proprietățile chimice și fizice, aplicarea și producerea oxigenului Oxigenul prezintă o stare de oxidare pozitivă în legătură cu ce?
Oxigenul prezintă o stare de oxidare pozitivă în legătură cu ce? Fosfor - metal sau nemetal? Elemente de proprietate
Fosfor - metal sau nemetal? Elemente de proprietate Elementul chimic este tipul de atomi cu aceeași încărcătură nucleară
Elementul chimic este tipul de atomi cu aceeași încărcătură nucleară Proprietăți metalice ale elementelor chimice
Proprietăți metalice ale elementelor chimice
 Sistemul periodic al lui Mendeleev. Elementele chimice ale tabelului periodic
Sistemul periodic al lui Mendeleev. Elementele chimice ale tabelului periodic Care este valența sulfului? Posibile valențe de sulf
Care este valența sulfului? Posibile valențe de sulf Modificări alotropice ale oxigenului: caracteristică și valoare comparativă
Modificări alotropice ale oxigenului: caracteristică și valoare comparativă Determinați valența elementelor chimice
Determinați valența elementelor chimice Masa moleculară a oxigenului. Care este masa molară de oxigen?
Masa moleculară a oxigenului. Care este masa molară de oxigen?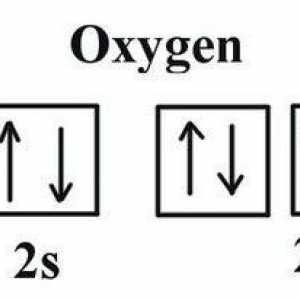 Care este valența de oxigen în compuși?
Care este valența de oxigen în compuși? Sistem periodic: clasificarea elementelor chimice
Sistem periodic: clasificarea elementelor chimice Cum se compune o ecuație chimică: reguli, exemple. Înregistrarea reacției chimice
Cum se compune o ecuație chimică: reguli, exemple. Înregistrarea reacției chimice Cum se determină compoziția calitativă și cantitativă a materiei
Cum se determină compoziția calitativă și cantitativă a materiei