Modelul planetar al lui Rutherford, atom în modelul Rutherford
Descoperirile în domeniul structurii atomice au devenit un pas important în dezvoltarea fizicii. O mare importanță a fost modelul lui Rutherford. Atomul ca sistem și particulele, componentele acestuia, a fost studiat mai precis și în detaliu. Acest lucru a dus la dezvoltarea cu succes a unei astfel de științe, cum ar fi fizica nucleară.
conținut
Concepte antice despre structura materiei
Presupunerea că corpurile din jur constau din cele mai mici particule au fost exprimate chiar și în cele mai vechi timpuri. Gânditorii de atunci reprezentau atomul sub forma unei particule mici și indivizibile de orice substanță. Ei au argumentat că nu există nimic mai mic în univers decât un atom. Astfel de opinii au fost ținute de marii învățați și filozofi greci antice - Democritus, Lucretius, Epicurus. Ipotezele acestor gânditori sunt unite astăzi sub numele de "atomism vechi".

Reprezentări medievale
Vremurile antichității au trecut, iar în Evul Mediu au existat și oameni de știință care au exprimat diverse ipoteze despre structura substanțelor. Cu toate acestea, prevalența vederilor filosofice religioase și puterea bisericii în această perioadă a istoriei la rădăcină a împiedicat toate încercările și aspirațiile minții umane la concluzii și descoperiri științifice materialiste. După cum știți, Inchiziția medievală era foarte neprietenoasă față de reprezentanții lumii științifice ale vremii. Rămâne să spunem că mințile de atunci strălucitoare proveneau din ideea antichității indivizibilității atomului.
Studii din secolele XVIII și XIX
Secolul al XVIII-lea a fost marcat de descoperiri serioase în domeniul structurii elementare a materiei. În multe privințe, datorită eforturilor unor oameni de știință precum Antoine Lavoisier, Mikhail Lomonosov și John Dalton. Indiferent unul de celălalt, au reușit să dovedească existența atomilor. Dar problema structurii lor interne a rămas deschisă. Sfârșitul secolului al XVIII-lea a fost marcat de un eveniment remarcabil în lumea științifică, precum descoperirea de către DI Mendeleev a sistemului periodic de elemente chimice. Aceasta a devenit o descoperire cu adevărat puternică a acelor timpuri și a deschis vălul peste înțelegerea faptului că toți atomii au o natură unificată, că sunt legați unul de celălalt. Mai târziu, în secolul al XIX-lea, un alt pas important spre dezintegrarea structurii atomului a fost dovada că există un electron în oricare dintre ele. Lucrarea oamenilor de știință din această perioadă a pregătit teren fertil pentru descoperirile secolului al XX-lea.

Experimentele lui Thomson
Fizicianul englez John Thomson în 1897 a dovedit că compoziția atomilor include electroni cu încărcătură negativă. În această etapă, noțiunea falsă că atomul este limita divizibilității oricărei substanțe a fost complet distrusă. Cum a reușit Thomson să demonstreze existența electronilor? Omul de știință din experimentele lui a fost plasat într-o poziție puternică gaze rare electrozi și au trecut un curent electric. Ca rezultat, au apărut raze catodice. Thomson a studiat cu atenție trăsăturile lor și a descoperit că sunt un flux de particule încărcate care se mișcă cu o viteză extraordinară. Omul de știință putea să calculeze masa acestor particule și încărcătura lor. De asemenea, el a aflat că ele nu pot fi convertite în particule neutre, deoarece încărcarea electrică este baza naturii lor. Așa au fost electronii sunt deschise. Thomson este, de asemenea, creatorul primului model mondial al structurii atomului. Potrivit acestuia, un atom este o grămadă de materie încărcată pozitiv, în care electronii încărcați negativ sunt uniform distribuiți. O astfel de structură explică neutralitatea generală a atomilor, deoarece taxele opuse se echilibrează reciproc. Experimentele lui John Thomson au devenit neprețuite pentru studierea în continuare a structurii atomului. Cu toate acestea, multe întrebări au rămas fără răspuns.

Cercetarea de către Rutherford
Thomson a descoperit existența electronilor, dar nu a putut găsi particule încărcate pozitiv în atom. Ernest Rutherford a corectat această neînțelegere în 1911. În timpul experimentelor, studiind activitatea particulelor alfa în gaze, el a descoperit că particulele sunt prezente în atom, încărcate pozitiv. Rutherford a văzut că atunci când razele trec printr-un gaz sau printr-o placă subțire de metal, o mică cantitate de particule se îndepărtează de pe traiectoria mișcării. Ei literalmente le-au aruncat înapoi. Cercetătorul a ghicit că acest comportament se datorează unei coliziuni cu particule încărcate pozitiv. Astfel de experimente au permis fizicianului să creeze un model al structurii atomului Rutherford.

Modelul planetar
Acum, opiniile omului de știință au fost oarecum diferite de ipotezele făcute de John Thomson. Modelele lor de atomi, de asemenea, au devenit diferite. Experiența lui Rutherford ia permis să creeze o teorie cu totul nouă în acest domeniu. Descoperirile omului de știință au avut o importanță decisivă pentru dezvoltarea fizică. Modelul Rutherford descrie atomul ca nucleu situat în centru și electronii care se mișcă în jurul acestuia. Nucleul are o sarcină pozitivă, iar electronii - unul negativ. Modelul atomului conform lui Rutherford a presupus rotirea electronilor în jurul nucleului de-a lungul anumitor traiectorii - orbite. Descoperirea omului de știință a ajutat la explicarea motivului pentru deformarea particulelor alfa și a devenit impulsul pentru dezvoltarea teoriei nucleare a atomului. În modelul atomului Rutherford, se observă o analogie cu mișcarea planetelor sistemului solar în jurul Soarelui. Aceasta este o comparație foarte precisă și vie. Prin urmare, modelul Rutherford, atomul în care orbitează nucleul din jurul nucleului, a fost numit planetar.

Lucrări ale lui Niels Bohr
Doi ani mai târziu, fizicianul danez Niels Bohr a încercat să combine idei despre structura atomului cu proprietățile cuantice ale fluxului luminos. Modelul nuclear al atomului de la Rutherford a fost plasat de om de știință în baza noii sale teorii. Conform presupunerii lui Bohr, atomii se rotesc în jurul nucleului de-a lungul orbitelor circulare. O astfel de traiectorie de mișcare conduce la o accelerare a electronilor. În plus, interacțiunea Coulomb a acestor particule cu centrul atomului este însoțită de crearea și consumul de energie pentru a menține câmpul electromagnetic spațial care rezultă din mișcarea electronilor. În astfel de condiții, particule încărcate negativ ar trebui să cadă într-o zi pe miez. Dar acest lucru nu se întâmplă, ceea ce indică o mai mare stabilitate a atomilor ca sisteme. Niels Bohr a realizat că legile termodinamicii clasice, descrise de ecuațiile lui Maxwell, nu funcționează în condiții intra-atomice. De aceea, omul de știință și-a stabilit sarcina de a deriva noi legi care ar fi valabile în lumea particulelor elementare.

Posterate de Bora
În mare măsură datorită faptului că există un model al lui Rutherford, atomul și componentele sale au fost bine studiate, Niels Bohr a reușit să se apropie de crearea postulatelor sale. Primul spune că atomul are stări staționare, sub care nu-și schimbă energia, iar electronii se deplasează de-a lungul orbitelor fără a-și schimba traiectoria. Conform celui de-al doilea postulat, atunci când un electron trece de la o orbită la alta, energia este eliberată sau absorbită. Ea este egală cu diferența dintre energiile statelor anterioare și ulterioare ale atomului. În acest caz, dacă electronul sare la o orbită de aproape-la-nucleu, atunci radiația energie (foton), și invers. În ciuda faptului că mișcarea electronilor are puține asemănări cu calea orbitale, care este strict deschiderea circumferențială Bora a dat o explicație excelentă pentru existența spectrului liniei atom de hidrogen. Aproximativ în același timp, fizicienii Hertz și Frank, care a trăit în Germania, a confirmat savantul Niels Bohr despre existența unor stări staționare, stabile ale atomului și posibilitatea apariției unor modificări ale valorilor energiei atomice.

Cooperarea a doi oameni de știință
Apropo, Rutherford nu a putut stabili mult timp încărcarea nucleului. Oamenii de știință Marsden și Geiger a încercat să efectueze revendicările verificarea încrucișată a Ernest Rutherford, și ca rezultat al experimentelor atente și detaliate și calcule au ajuns la concluzia că este nucleul caracteristica majoră a atomului, și se concentrează toată încărcătura. Mai târziu sa dovedit că taxa nucleară este numeric egală cu valoarea numărului de ordine al elementului din tabelul periodic al lui Mendeleev. Interesant, Bohr Niels întâlnit în curând cu Rutherford și pe deplin de acord cu opiniile sale. Ulterior, oamenii de știință au lucrat mult timp împreună în același laborator. model al atomului ca un sistem format din elementare ale lui Rutherford particule încărcate - toate Niels Bohr a considerat echitabil și pentru toate pus deoparte modelul lor electronice. Activități comune de cercetare de oameni de știință a fost foarte mare succes și a dat roade. Fiecare dintre ei cufundat în studiul proprietăților particulelor elementare și a făcut descoperiri semnificative în domeniul științei. Mai târziu, Rutherford a descoperit și a demonstrat posibilitatea extinderii miezului, dar asta e un subiect pentru un alt articol.
 Electronii sunt ce? Proprietățile și istoria descoperirii electronilor
Electronii sunt ce? Proprietățile și istoria descoperirii electronilor Modele ale atomilor lui Thomson și Rutherford pentru scurt timp
Modele ale atomilor lui Thomson și Rutherford pentru scurt timp Structura atomului. Modelul cuantic-mecanic al unui atom
Structura atomului. Modelul cuantic-mecanic al unui atom Ce particule a descoperit Rutherford? Experiența și schema experienței lui Rutherford
Ce particule a descoperit Rutherford? Experiența și schema experienței lui Rutherford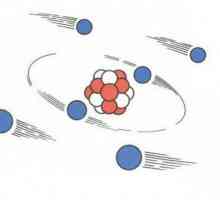 Să vorbim despre cum să găsim protoni, neutroni și electroni
Să vorbim despre cum să găsim protoni, neutroni și electroni Informații de bază despre structura atomului: caracteristici, trăsături și formulă
Informații de bază despre structura atomului: caracteristici, trăsături și formulă Experimentul Rutherford privind împrăștierea particulelor alfa (pe scurt)
Experimentul Rutherford privind împrăștierea particulelor alfa (pe scurt) Cine a propus modelul nuclear al structurii atomului? Modelul nuclear al structurii atomice și…
Cine a propus modelul nuclear al structurii atomului? Modelul nuclear al structurii atomice și… Care este diametrul unui atom? Dimensiunea atomului
Care este diametrul unui atom? Dimensiunea atomului Greutatea protonului
Greutatea protonului Încărcarea de protoni este valoarea de bază a fizicii particulelor elementare
Încărcarea de protoni este valoarea de bază a fizicii particulelor elementare Experiența lui Rutherford
Experiența lui Rutherford Descoperirea unui proton și a unui neutron
Descoperirea unui proton și a unui neutron Ce sunt electronii de valență?
Ce sunt electronii de valență? Care este starea excitat a unui atom
Care este starea excitat a unui atom Masa unui neutron, a unui proton, a unui electron - ce este comun?
Masa unui neutron, a unui proton, a unui electron - ce este comun? Ce este degradarea alfa?
Ce este degradarea alfa?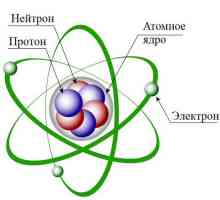 Ce depinde numărul de electroni din atom și de pe el?
Ce depinde numărul de electroni din atom și de pe el?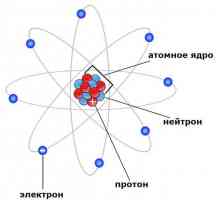 Care sunt nucleonii și ce pot fi construiți din ele?
Care sunt nucleonii și ce pot fi construiți din ele? Modelul planetar al atomului: justificarea teoretică și dovezile practice
Modelul planetar al atomului: justificarea teoretică și dovezile practice Configurația electronică - secretele structurii atomului
Configurația electronică - secretele structurii atomului
 Modele ale atomilor lui Thomson și Rutherford pentru scurt timp
Modele ale atomilor lui Thomson și Rutherford pentru scurt timp Structura atomului. Modelul cuantic-mecanic al unui atom
Structura atomului. Modelul cuantic-mecanic al unui atom Ce particule a descoperit Rutherford? Experiența și schema experienței lui Rutherford
Ce particule a descoperit Rutherford? Experiența și schema experienței lui Rutherford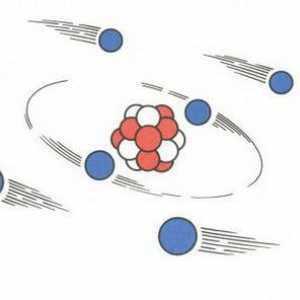 Să vorbim despre cum să găsim protoni, neutroni și electroni
Să vorbim despre cum să găsim protoni, neutroni și electroni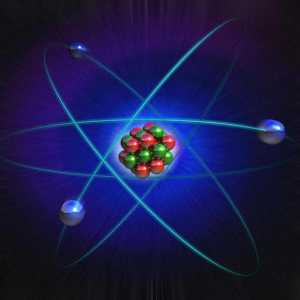 Informații de bază despre structura atomului: caracteristici, trăsături și formulă
Informații de bază despre structura atomului: caracteristici, trăsături și formulă Experimentul Rutherford privind împrăștierea particulelor alfa (pe scurt)
Experimentul Rutherford privind împrăștierea particulelor alfa (pe scurt) Cine a propus modelul nuclear al structurii atomului? Modelul nuclear al structurii atomice și…
Cine a propus modelul nuclear al structurii atomului? Modelul nuclear al structurii atomice și… Care este diametrul unui atom? Dimensiunea atomului
Care este diametrul unui atom? Dimensiunea atomului