Formula structurală și moleculară: acetilenă
Caracteristicile structurii acetilenei îi afectează proprietățile, producția și aplicarea. Denumirea convențională a substanței -2
conținut
Alchine. Formula generală. acetilenă
Hidrocarburile de alchin sau acetilenă sunt aciclice, nesaturate. Lanțul atomilor de carbon nu este închis, există legături simple și multiple în el. Compoziția alchinelor reflectă formula sumară CnH2n- 2. În moleculele substanțelor din această clasă, există una sau mai multe legături triple. Compușii acetilenici se referă la compuși nesaturați. Aceasta înseamnă că doar o valență de carbon este realizată datorită hidrogenului. Celelalte trei legături sunt utilizate atunci când interacționează cu alți atomi de carbon.
Primul - și cel mai faimos reprezentant al alchinelor - acetilenă sau etină. Numele trivial al substanței provine din cuvântul latin "acetum" - "oțet" și din greacă - "hyle" - "copac". Fondatorul seriei omoloage a fost deschis în 1836, experimente chimice, Mai târziu, substanța a fost sintetizată din cărbune și hidrogen de E. Davy și M. Bertlo (1862). La temperatura normală și la presiunea atmosferică normală, acetilena este în stare gazoasă. Este un gaz incolor, inodor, ușor solubil în apă. Etina este mai ușor solubilă în etanol și acetonă.

Formula moleculară a acetilenei
Etin - cel mai simplu membru al seriei omoloage, compoziția și structura sa reflectă formulele:
- C2H2 - o înregistrare moleculară a compoziției etanului, care dă o idee că substanța este formată din doi atomi de carbon și același număr de atomi de hidrogen. Conform acestei formule, este posibil să se calculeze valorile moleculare și molară conexiune. Dl (de la2H2) = 26 a. e. m., M (C.2H2) = 26,04 g / mol.
- Н: С ::: С: Н - formula electron-punct de acetilenă. Astfel de imagini, numite "structurile lui Lewis", reflectă structura electronică moleculă. Prin Trebuie respectate regulile de scriere: atomul de hidrogen tinde să aibă configurație legare chimică a mantalei de valență de heliu, alte elemente - octetul exterior al electronilor. Fiecare colon este comun la doi atomi sau o singură pereche de electroni din stratul exterior.
- H-Cequiv-C-H este formula structurală a acetilenei, care reflectă ordinea și multiplicitatea legăturilor dintre atomi. O bordură înlocuiește o pereche de electroni.

Modele ale moleculei acetilene
Formulele care arată distribuția de electroni a servit ca bază pentru crearea de modele orbitale atomice, molecule formule spațiale (stereochimia). Chiar și la sfârșitul secolului al XVIII-lea au proliferat modelul sharosterzhnevye - de exemplu, bile de diferite culori și mărimi, indicând carbon și hidrogen care formează acetilena. Formula structurală a unei molecule este reprezentată sub formă de tije, care simbolizează legăturile chimice și numărul lor în fiecare atom.

Modelul Sharosterzhnevaya reproduce legătură cu acetilenă unghiuri egale cu 180 °, dar într-o moleculă de distanță internuclear reflectată aproximativ. Golurile dintre bile nu creează o imagine a umplerii spațiului atomilor cu densitate electronică. Dreydinga dezavantaj este eliminat în modelele indicative de nuclee atomice nu sunt bilele, și punctele de racordare a barelor între ele. Modelele volumetrice moderne dau o idee mai vie despre orbitele atomice și moleculare.
Oblete atomice hibride de acetilenă
Carbonul în starea excitată conține trei p-orbitale și unul cu electroni nepereche. În formarea metanului (CH4) participă la crearea legăturilor echivalente cu atomii de hidrogen. Un cercetător american celebru L. Pauling a dezvoltat teoria stării hibride a orbitalilor atomici (AO). Explicarea comportamentului carbonului în reacțiile chimice este alinierea AO în formă și energie, formarea de noi nori. Porturile orbite hibride oferă conexiuni mai puternice, formula devine mai stabilă.
Atomii de carbon din molecula acetilenă, spre deosebire de metan, suferă sp-hibridizare. S și electronii p sunt amestecați în formă și energie. Două orbite sp-apar, situate la un unghi de 180 °, îndreptate pe laturile opuse ale nucleului.

Conexiune triplă
În acetilenă, norii de carbon hibrid sunt implicați în crearea de sigma - legături cu aceiași atomi vecini și cu hidrogen în perechi C-H. Există două p-orbitale ne-hibride perpendiculare unele pe altele. În molecula de etilenă, ei participă la formarea a două pi - constrângeri. Împreună cu sigma - există o legătură triplă, care reflectă formula structurală. Acetilena diferă de etan și etilenă de distanța dintre atomi. Legătura triplă este mai scurtă decât cea dublă, dar are o rezervă mai mare de energie, este mai solidă. Densitate maximă sigma ... și pi-legăturile sunt situate în regiuni perpendiculare, ceea ce duce la formarea unui nor de electroni cilindric.
Caracteristicile legăturii chimice în acetilenă
Molecula de etilenă are o formă liniară, care reflectă cu succes formula chimică a acetilenă-H-Cequiv-C-H. Atomii de carbon și de hidrogen sunt de-a lungul unei linii drepte, 3 apar între ele sigma ... și 2 pi - conexiune. Libera circulație, rotația de-a lungul axei C-C este imposibilă, acest lucru este împiedicat de prezența unor legături multiple. Alte caracteristici ale legăturii triple:
- numărul de perechi de electroni care leagă doi atomi de carbon este de 3;
- lungime - 0.120 nm;
- Energia rupturii este de 836 kJ / mol.
Pentru comparație: în moleculele de etan și etilenă lungime unică și o legătură chimică dublă - 1,54 și 1,34 nm, respectiv, diferența de energie C-C este de 348 kJ / mol, C = C - 614 kJ / mol.

Homologii de acetilenă
Acetilena este cel mai simplu reprezentant al alchinelor, ale căror molecule au și o legătură triplă. Propyn CH3Cequiv-CH este omologul acetilenei. Formula celui de-al treilea reprezentant al alchin-butin-1-CH3CH2Sequiv-CH. Acetilena este numele trivial al etanului. Nomenclatura sistematică Alkines respectă regulile IUPAC:
- în molecule lineare indica numele lanțului principal, care a apărut din numeralul grecesc, la care se adaugă -in sufix și numărul atomic cu o triplă legătură, de exemplu, etinil, propinil, butin-1;
- numerotarea lanțului principal de atomi începe la sfârșitul moleculei cel mai aproape de legătura triplă;
- pentru hidrocarburile ramificate, este mai întâi urmată denumirea ramurii laterale, urmată de numele lanțului principal de atomi cu sufixul - in.
- partea finală a numelui - o figură care indică localizarea legăturii triple în moleculă, de exemplu, butyn-2.

Izomerismul alchinilor. Dependența proprietăților de structură
Etina și propina nu au izomeri ai poziției triple de legături, ele apar odată cu butina. Izomerii scheletului de carbon sunt în pentină și următoarele omologi. Izomerismul spațial al hidrocarburilor acetilenice nu se manifestă în raport cu legătura triplă.
Primele 4 omologi de etanol sunt gaze care sunt slab solubile în apă. Hidrocarburi de acetilenă5 - C15 - lichid. Solidele sunt omologi ai etanului, pornind de la hidrocarbură C17. Natura chimică a alchinelor este semnificativ afectată de legătura triplă. Hidrocarburile din aceasta tip mai activ decât etilenă, atașați particule diferite. Această proprietate se bazează pe utilizarea pe scară largă a etanului în industrie și inginerie. La arderea acetilenei, se eliberează o cantitate mare de căldură, care se aplică la tăierea gazelor și sudarea metalelor.
 Ce este o substanță complexă? Cum se întâmplă?
Ce este o substanță complexă? Cum se întâmplă?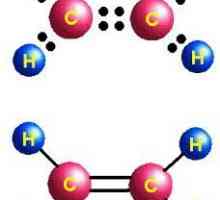 Primul reprezentant al alkenelor este etilenă. Proprietățile fizice, producția, aplicarea etilenei
Primul reprezentant al alkenelor este etilenă. Proprietățile fizice, producția, aplicarea etilenei Formula benzenului: care dintre variante este corectă?
Formula benzenului: care dintre variante este corectă? Clasificarea substanțelor organice - baza pentru studiul chimiei organice
Clasificarea substanțelor organice - baza pentru studiul chimiei organice Formula moleculară și structurală a fenolului
Formula moleculară și structurală a fenolului Formula chimică a glicerinei. Formula structurală și moleculară
Formula chimică a glicerinei. Formula structurală și moleculară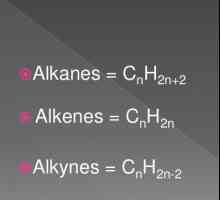 Formula generală a alchenelor. Proprietățile și caracteristicile alkenelor
Formula generală a alchenelor. Proprietățile și caracteristicile alkenelor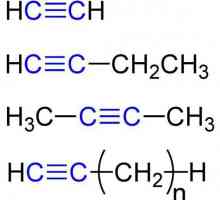 Proprietăți chimice ale alchinelor. Structura, recepția, aplicarea
Proprietăți chimice ale alchinelor. Structura, recepția, aplicarea Cum se fac izomeri și omologi? Cum se fac izomerii alcanilor?
Cum se fac izomeri și omologi? Cum se fac izomerii alcanilor? Structura spațială a moleculelor de substanțe anorganice și organice
Structura spațială a moleculelor de substanțe anorganice și organice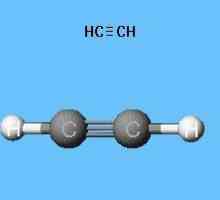 Cum să obțineți acetilenă din metan
Cum să obțineți acetilenă din metan Cum să obțineți acetilenă din metan
Cum să obțineți acetilenă din metan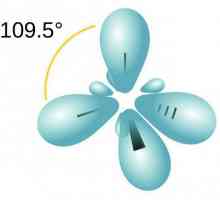 Să vorbim despre cum să determinăm tipul de hibridizare
Să vorbim despre cum să determinăm tipul de hibridizare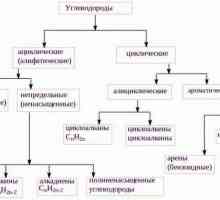 Sunt hidrocarburile alifatice?
Sunt hidrocarburile alifatice? Izomerii structurali sunt ceea ce
Izomerii structurali sunt ceea ce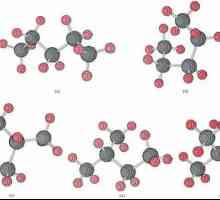 Pentan: izomeri și nomenclatură
Pentan: izomeri și nomenclatură Hidrocarburi limită: caracteristici generale, izomerie, proprietăți chimice
Hidrocarburi limită: caracteristici generale, izomerie, proprietăți chimice Seria de omologie
Seria de omologie Diene hidrocarburi: structura, izomerismul și nomenclatura
Diene hidrocarburi: structura, izomerismul și nomenclatura Alkines: producție, aplicare, proprietăți
Alkines: producție, aplicare, proprietăți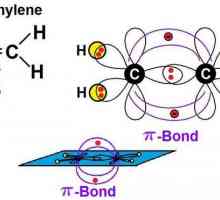 Alkenes: formula. Proprietăți chimice. recepție
Alkenes: formula. Proprietăți chimice. recepție
 Primul reprezentant al alkenelor este etilenă. Proprietățile fizice, producția, aplicarea etilenei
Primul reprezentant al alkenelor este etilenă. Proprietățile fizice, producția, aplicarea etilenei Formula benzenului: care dintre variante este corectă?
Formula benzenului: care dintre variante este corectă? Formula moleculară și structurală a fenolului
Formula moleculară și structurală a fenolului Formula chimică a glicerinei. Formula structurală și moleculară
Formula chimică a glicerinei. Formula structurală și moleculară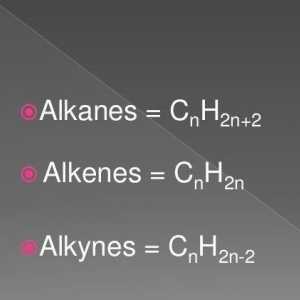 Formula generală a alchenelor. Proprietățile și caracteristicile alkenelor
Formula generală a alchenelor. Proprietățile și caracteristicile alkenelor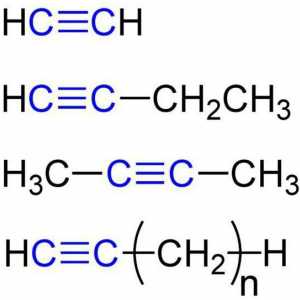 Proprietăți chimice ale alchinelor. Structura, recepția, aplicarea
Proprietăți chimice ale alchinelor. Structura, recepția, aplicarea Cum se fac izomeri și omologi? Cum se fac izomerii alcanilor?
Cum se fac izomeri și omologi? Cum se fac izomerii alcanilor? Structura spațială a moleculelor de substanțe anorganice și organice
Structura spațială a moleculelor de substanțe anorganice și organice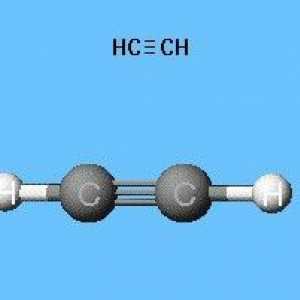 Cum să obțineți acetilenă din metan
Cum să obțineți acetilenă din metan