Reacții calitative la fenol. Prepararea fenolilor: reacții
Acid carbolic - unul dintre denumirile fenolului, indicând comportamentul său special în procesele chimice. Această substanță este mai ușoară decât benzenul care intră în reacția de substituție nucleofilă. Proprietățile acide inerente în compus sunt explicate prin mobilitatea atomului de hidrogen din gruparea hidroxil legată de inel. Studiul structurii moleculei și reacțiile calitative ale fenolului fac posibilă clasificarea substanței drept compuși aromatici - derivați ai benzenului.
conținut
Fenolul (hidroxibenzen)
În 1834, chimistul german Runge a izolat acidul carbolic din gudron de cărbune, dar nu a reușit să-i descifreze compoziția. Mai târziu, alți cercetători au propus o formulă și au atribuit noul compus alcoolilor aromatici. Cel mai simplu reprezentant al acestui grup este fenolul (hidroxibenzen). În forma sa pură, această substanță este un cristal transparent, cu un miros caracteristic. În aer, culoarea fenolului se poate schimba, devenind roz sau roșu. Alcoolul aromatic se caracterizează prin solubilitate scăzută în apă rece și bună în solvenți organici. Fenolul se topește la o temperatură de 43 ° C Este un compus toxic, când devine pe piele, provoacă arsuri grave. Partea aromatică a moleculei este reprezentată de fenil radical (C6H5-). Oxigenul grupării hidroxil (-OH) este legat direct la unul dintre atomii de carbon. Prezența fiecăruia dintre particule dovedește reacția calitativă corespunzătoare la fenol. Formula care arată conținutul total de atomi de elemente chimice din moleculă este C6H6O. Structura este reflectată formule structurale, inclusiv ciclul Kekule și grupul funcțional - hidroxil. O reprezentare vizuală a moleculei de alcool aromatic este furnizată de modele sferice.

Caracteristicile structurii moleculei
Interdelarea nucleului benzenic cu grupul OH determină reacțiile chimice ale fenolului cu metale, halogeni și alte substanțe. Prezența unui atom de oxigen asociat cu ciclul aromatic conduce la o redistribuire a densității electronice în moleculă. Legătura O-H devine mai polară, ceea ce conduce la o creștere a mobilității hidrogenului în gruparea hidroxil. Protonul poate fi înlocuit cu atomi de metal, ceea ce indică aciditatea fenolului. La rândul său, gruparea OH crește proprietățile de reacție ale inelului benzenic. Delocalizarea electronilor și capacitatea de substituție electrofilă în nucleu sunt în creștere. Aceasta crește mobilitatea atomilor de hidrogen asociate cu carbonul în pozițiile orto- și para (2, 4, 6). Acest efect se datorează prezenței unei grupări donor-hidroxil de densitate electronică. Datorită influenței sale, fenolul este mai activ decât benzenul în reacțiile cu anumite substanțe, iar noii substituenți sunt orientați către pozițiile orto-para.

Proprietăți acide
În grupa hidroxil a alcoolilor aromatici, atomul de oxigen dobândește o sarcină pozitivă, slăbind legătura cu hidrogen. Eliberarea protonului este facilitată, astfel încât fenolul se comportă ca un acid slab, dar mai puternic decât alcoolii. Reacțiile calitative la fenol includ un test de greutate, care schimbă culoarea de la albastru la roz în prezența protonilor. Prezența atomilor de halogen sau a grupărilor nitro legate la inelul benzenic conduce la o creștere a activității hidrogenului. Efectul este observat în moleculele derivatelor nitro ale fenolului. Reduce aciditatea unor astfel de substituenți cum ar fi gruparea amino și alchil (CH3-, C2H5- și alții). La compușii care combină un inel benzenic, o grupare hidroxil și un radical metil în compoziția lor, este inclusă crezolul. Proprietățile sale sunt mai slabe decât acidul carbolic.
Reacția fenolului cu sodiu și alcaline
 Ca și acizii, fenolul interacționează cu metalele. De exemplu, reacționează cu sodiu: 2C6H5-OH + 2Na = 2C6H5-ONa + H2uarr-. format fenolat de sodiu, și gazul hidrogen este eliberat. Fenolul reacționează cu baze solubile. este reacție de neutralizare pentru a forma o sare și apă: C6H5-OH + NaOH = C6H5-ONa + H2O. Capacitatea de a da hidrogen în grupa hidroxil a fenolului este mai scăzută decât în majoritatea acizilor anorganici și carboxilici. Se elimină din săruri chiar dizolvate în apă dioxid de carbon (acid carbonic). Ecuația de reacție: C6H5-ONa + CO2 + H2O = C6H5-OH + NaHCO3.
Ca și acizii, fenolul interacționează cu metalele. De exemplu, reacționează cu sodiu: 2C6H5-OH + 2Na = 2C6H5-ONa + H2uarr-. format fenolat de sodiu, și gazul hidrogen este eliberat. Fenolul reacționează cu baze solubile. este reacție de neutralizare pentru a forma o sare și apă: C6H5-OH + NaOH = C6H5-ONa + H2O. Capacitatea de a da hidrogen în grupa hidroxil a fenolului este mai scăzută decât în majoritatea acizilor anorganici și carboxilici. Se elimină din săruri chiar dizolvate în apă dioxid de carbon (acid carbonic). Ecuația de reacție: C6H5-ONa + CO2 + H2O = C6H5-OH + NaHCO3.
Reacțiile inelului benzenic
Proprietățile aromatice se datorează delocalizării electronilor în nucleul benzenului. Hidrogenul din inel este înlocuit cu atomi de halogen, nitro. Un proces similar într-o moleculă de fenol este mai ușor decât în benzen. Un exemplu este bromurarea. Halogenul acționează asupra benzenului în prezența unui catalizator, se obține brombenzen. Fenolul reacționează cu apă de brom în condiții normale. Ca urmare a interacțiunii, se formează un precipitat alb de 2,4,6-tribromofenol, a cărui apariție face posibilă distingerea substanței testate de compușii aromatici asemănători. Bromarea este o reacție calitativă la fenol. Ecuația: C6H5-OH + 3Br2 = C6H2Br3 + HBr. Al doilea produs al reacției este bromura de hidrogen. Când fenolul reacționează cu un diluat acid azotic nitro derivați. Produsul de reacție cu acid azotic concentrat - 2,4,6-trinitrofenol sau acid picric are o mare importanță practică.

Reacții calitative la fenol. Listă de
În interacțiunea substanțelor se obțin anumite produse care ne permit să stabilim compoziția calitativă a substanțelor inițiale. Un număr de reacții de culoare indică prezența unor particule, grupuri funcționale, care este convenabilă pentru analiza chimică. Răspunsurile calitative la fenol dovedesc prezența în moleculă a substanței inelului aromatic și a grupării OH:
- În soluția de fenol, hârtia albastră de litmus devine roșie.
- Reacțiile de culoare pentru fenoli se efectuează, de asemenea, într-un mediu slab slab alcalin cu săruri de diazoniu. Se formează azo-coloranți galbui sau portocaliu.
- Reacționează cu apă brună de culoare maro, apare un precipitat alb de tribromofenol.
- Ca urmare a reacției cu o soluție de clorură ferică, se obține fenoxidul feric - o substanță de culoare albastru, violet sau verde.

Prepararea fenolilor
Producția de fenol în industrie merge în două sau trei etape. În prima etapă, din propilenă și benzen în prezența clorură de aluminiu cumen (denumirea trivială a izopropilbenzenului). Ecuația de reacție Friedel-Crafts este C6H5-OH + C3H6 = C9H12 (cumen). Benzolul și propilena într-un raport de 3: 1 sunt trecute peste catalizatorul acid. Din ce în ce mai mult, în loc de catalizatorul tradițional - clorura de aluminiu - se utilizează zeoliții ecologici. În etapa finală, se efectuează oxidarea cu oxigen în prezența acidului sulfuric: C6H5-C3H7 + 02 = C6H5-OH + C3H60. Fenolii pot fi obținuți din cărbune prin distilare, sunt intermediari în producerea altor substanțe organice.

Utilizarea fenolilor
Aromele aromatice sunt utilizate pe scară largă în producția de materiale plastice, coloranți, pesticide și alte substanțe. Producerea acidului carbolic din benzen este prima etapă în crearea unui număr de polimeri, inclusiv policarbonații. Fenolul reacționează cu formaldehida, se obțin rășini fenol-formaldehidice.

Ciclohexanolul servește ca materie primă pentru producerea de poliamide. Fenolii sunt utilizați ca antiseptice și dezinfectanți în deodorante, loțiuni. Folosit pentru a produce fenacetin, acid salicilic și alte medicamente. Fenolii sunt utilizate în producția de rășini care sunt utilizate în produsele electrice (întrerupătoare, prize). Sunt de asemenea utilizate pentru prepararea coloranților azo, de exemplu fenilamină (anilină). Acidul picric, care este un derivat nitro al fenolului, este folosit pentru vopsirea țesăturilor, făcând explozivi.
 Benzen: proprietăți fizice și chimice, structură și descriere
Benzen: proprietăți fizice și chimice, structură și descriere Formula benzenului: care dintre variante este corectă?
Formula benzenului: care dintre variante este corectă? Formula de toluen: ce este toluenul și cum se obține?
Formula de toluen: ce este toluenul și cum se obține?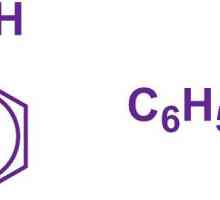 Formula moleculară și structurală a fenolului
Formula moleculară și structurală a fenolului Reacții calitative la substanțe organice, anioni, cationi
Reacții calitative la substanțe organice, anioni, cationi Prepararea benzenului
Prepararea benzenului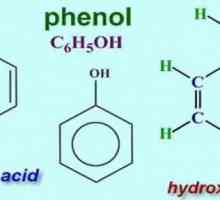 Phenoli este ce? Proprietățile și compoziția fenolului
Phenoli este ce? Proprietățile și compoziția fenolului Hidrocarburi aromatice: reprezentanții principali și aplicarea lor în economia națională.
Hidrocarburi aromatice: reprezentanții principali și aplicarea lor în economia națională. Izomerii structurali sunt ceea ce
Izomerii structurali sunt ceea ce Ce este benzenul? Structura benzenului, formula, proprietățile, aplicația
Ce este benzenul? Structura benzenului, formula, proprietățile, aplicația Proprietati chimice ale alcoolilor
Proprietati chimice ale alcoolilor Acid benzoic
Acid benzoic Acid carboxilic
Acid carboxilic Alcool benzilic: proprietăți, producție, aplicare
Alcool benzilic: proprietăți, producție, aplicare Fenolate de sodiu: preparat, proprietăți chimice
Fenolate de sodiu: preparat, proprietăți chimice Acid picric: o scurtă descriere a substanței
Acid picric: o scurtă descriere a substanței Proprietăți chimice ale sărurilor și metode de preparare a acestora
Proprietăți chimice ale sărurilor și metode de preparare a acestora Compuși care conțin oxigen: exemple, proprietăți, formule
Compuși care conțin oxigen: exemple, proprietăți, formule Aplicarea fenolului
Aplicarea fenolului Alcooli monohidrici, proprietățile lor fizice și chimice
Alcooli monohidrici, proprietățile lor fizice și chimice Care sunt proprietățile acide?
Care sunt proprietățile acide?
 Formula benzenului: care dintre variante este corectă?
Formula benzenului: care dintre variante este corectă? Formula de toluen: ce este toluenul și cum se obține?
Formula de toluen: ce este toluenul și cum se obține? Formula moleculară și structurală a fenolului
Formula moleculară și structurală a fenolului Reacții calitative la substanțe organice, anioni, cationi
Reacții calitative la substanțe organice, anioni, cationi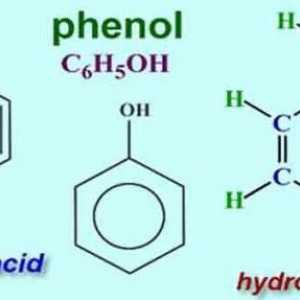 Phenoli este ce? Proprietățile și compoziția fenolului
Phenoli este ce? Proprietățile și compoziția fenolului Izomerii structurali sunt ceea ce
Izomerii structurali sunt ceea ce Ce este benzenul? Structura benzenului, formula, proprietățile, aplicația
Ce este benzenul? Structura benzenului, formula, proprietățile, aplicația