Toată lumea ar trebui să știe cum să găsească masa unei substanțe
Cursul chimiei școlare este un manual introductiv într-o știință complexă. De la început, elevii încearcă să înțeleagă cum să rezolve problemele de proiectare. Lăsați-i în primele etape să aibă o mică aplicație practică, dar dacă elevul a învățat, de exemplu, cum să găsiți masa substanțe reacționate, atunci poate să ceară destul de multe realizări serioase.

Luați în considerare un exemplu simplu al unei probleme, pe baza căreia puteți învăța să rezolvați probleme mai complexe. Să presupunem că pentru combustie completă monoxid de carbon (II) ai nevoie de 11,2 litri. Cati grame de CO2 ai primit?
1. Vom compune reacție.
CO + O2 = CO2
2. Egal pentru oxigen. Există o regulă care în majoritatea cazurilor vă poate ajuta. Începeți să aranjați coeficienții din acea substanță al cărei număr de atomi este ciudat. În acest caz, este oxigen în moleculă de CO. La aceasta am pus coeficientul 2. Deoarece pe stânga s-au format doi atomi de carbon, iar pe partea dreaptă unul, am pus 2 înainte de CO2. Astfel, obținem:
2CO + 02 = 2CO2
După cum puteți vedea, există patru atomi de oxigen în părțile din stânga și din dreapta. Carbonul este, de asemenea, în echilibru. Prin urmare, ei au sunat corect.

3. Apoi găsiți numărul de O2. definiție greutate moleculară pentru elevii școlii este prea greoaie și dificil de reținut, deci utilizați o altă metodă. Amintiți-vă că există un volum molar, care este de 22,4 litri / mol. Trebuie să găsiți câte languri (n) au reacționat: n = V / V m. În cazul nostru, n = 0,5 mol.
4. Acum alcătuiți proporția. Cantitatea de oxigen reacționată este de jumătate din cea a n (CO2). Aceasta rezultă din faptul că 0,5 mol / l = x mol / 2. Un simplu raport dintre cele două cantități a ajutat la formarea ecuației corecte. Când am găsit x = 1, putem obține un răspuns la întrebarea cum să găsim masa.
5. Adevărul pentru început este necesar să ne amintim încă o formulă: m = M * n. Ultima variabilă a fost găsită, dar ce să faci cu M? Masa moleculară - este valoarea experimentală stabilită în raport cu hidrogenul. Ea este desemnată prin litera M. Acum știm că m (CO2) = 12 g / mol * 1 mol = 12 g. Așa că am primit răspunsul. După cum puteți vedea, nu este nimic complicat.

Această sarcină este foarte simplă cu privire la o mulțime de alții. Dar principalul lucru este să înțelegem cum să găsim masă. Imaginați-vă o moleculă de substanță. De mult timp a fost cunoscut faptul că o molie constă din 6 * 10 ^ 23 molecule. În același timp, în elementul tabel periodic există o greutate instalată per 1 mol. Uneori este necesar să se calculeze masa molară a substanței. Se presupune că M (H20) = 18 grame / mol. Adică, o moleculă de hidrogen are M = 1 gram / mol. Dar apa conține doi atomi H. De asemenea, nu uitați de prezența oxigenului, care ne dă alte 16 grame. Rezumând, obținem 18 grame / mol.
Calculul teoretic al masei va avea ulterior o aplicare practică. Mai ales pentru studenții care așteaptă un atelier chimic. Nu vă fie teamă de acest cuvânt dacă studiați într-o școală non-core. Dar dacă chimia este subiectul principal, este mai bine să nu rulați conceptele de bază. Deci, acum știi cum să găsești masă. Amintiți-vă că în chimie este foarte important să fiți o persoană consistentă și considerată, care nu numai că cunoaște anumiți algoritmi, ci știe și cum să le aplicați.
 Ce este o substanță complexă? Cum se întâmplă?
Ce este o substanță complexă? Cum se întâmplă? Amidon: formula, proprietăți și multe altele
Amidon: formula, proprietăți și multe altele Organic materia caracteristicile și clasificarea lor
Organic materia caracteristicile și clasificarea lor Masa moleculară a oxigenului. Care este masa molară de oxigen?
Masa moleculară a oxigenului. Care este masa molară de oxigen? Cum se compune o ecuație chimică: reguli, exemple. Înregistrarea reacției chimice
Cum se compune o ecuație chimică: reguli, exemple. Înregistrarea reacției chimice Care este schema de echilibrare electronică?
Care este schema de echilibrare electronică? Substanțe anorganice
Substanțe anorganice Monoxid de carbon
Monoxid de carbon Cum se determină compoziția calitativă și cantitativă a materiei
Cum se determină compoziția calitativă și cantitativă a materiei Ecuațiile chimice: cum să rezolve cel mai eficient
Ecuațiile chimice: cum să rezolve cel mai eficient Cum se găsește masa molară
Cum se găsește masa molară Alotropia este ... Definirea conceptului și a cauzei
Alotropia este ... Definirea conceptului și a cauzei Dioxid de carbon
Dioxid de carbon Seria de omologie
Seria de omologie Substanțe simple
Substanțe simple Structura materiei
Structura materiei Conexiuni complexe. Definiție, clasificare
Conexiuni complexe. Definiție, clasificare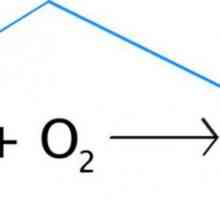 Cum să aranjăm coeficienții în ecuațiile chimice? Ecuatii chimice
Cum să aranjăm coeficienții în ecuațiile chimice? Ecuatii chimice Elementul chimic este tipul de atomi cu aceeași încărcătură nucleară
Elementul chimic este tipul de atomi cu aceeași încărcătură nucleară Masa moleculară relativă este o cantitate fizică specifică fiecărei substanțe
Masa moleculară relativă este o cantitate fizică specifică fiecărei substanțe Masa molară? Tabel pentru a ajuta!
Masa molară? Tabel pentru a ajuta!
 Masa moleculară a oxigenului. Care este masa molară de oxigen?
Masa moleculară a oxigenului. Care este masa molară de oxigen? Cum se compune o ecuație chimică: reguli, exemple. Înregistrarea reacției chimice
Cum se compune o ecuație chimică: reguli, exemple. Înregistrarea reacției chimice Care este schema de echilibrare electronică?
Care este schema de echilibrare electronică? Cum se determină compoziția calitativă și cantitativă a materiei
Cum se determină compoziția calitativă și cantitativă a materiei Ecuațiile chimice: cum să rezolve cel mai eficient
Ecuațiile chimice: cum să rezolve cel mai eficient