Numărul Avogadro: informații interesante
Din ciclul de școală al chimiei știm că dacă vom lua un mol de substanță, atunci acesta va conține 6,02214084 (18) • 10-23 atomi sau alte elemente structurale (molecule, ioni etc.). Pentru confort, numărul lui Avogadro este de obicei scris în următoarea formă: 6.02 • 10 ^ 23.
 Cu toate acestea, de ce este constantă Avogadro (în limba ucraineană "Avogadro" a devenit) egală cu această valoare? Răspunsul la această întrebare din manuale lipsește, iar istoricii din chimie oferă o varietate de versiuni. Se pare că numărul lui Avogadro are un sens secret. La urma urmei, există și numere magice, unde unele includ numărul "pi", numerele Fibonacci, șapte (în est opt), 13, etc. Vom lupta cu vidul informațional. Despre cine este Amedeo Avogadro și de ce, în cinstea acestui om de știință, pe lângă legea pe care a formulat-o, sa găsit o constantă și pe craterul de pe Lună, nu vom vorbi. Acest lucru este deja scris o mulțime de articole.
Cu toate acestea, de ce este constantă Avogadro (în limba ucraineană "Avogadro" a devenit) egală cu această valoare? Răspunsul la această întrebare din manuale lipsește, iar istoricii din chimie oferă o varietate de versiuni. Se pare că numărul lui Avogadro are un sens secret. La urma urmei, există și numere magice, unde unele includ numărul "pi", numerele Fibonacci, șapte (în est opt), 13, etc. Vom lupta cu vidul informațional. Despre cine este Amedeo Avogadro și de ce, în cinstea acestui om de știință, pe lângă legea pe care a formulat-o, sa găsit o constantă și pe craterul de pe Lună, nu vom vorbi. Acest lucru este deja scris o mulțime de articole.
Mai precis, Amedeo Avogadro nu sa ocupat de calculul moleculelor sau al atomilor într-un anumit volum. Primul care încearcă să afle cât de multe molecule de gaz  este conținută într-un volum dat la aceeași presiune și temperatură, a fost Josef Loschmidt, și a fost în 1865. Ca rezultat al experimentelor sale, Loschmidt a ajuns la concluzia că într-un centimetru cub de orice gaz, în condiții obișnuite, există 2.68675 • 10 ^ 19 molecule.
este conținută într-un volum dat la aceeași presiune și temperatură, a fost Josef Loschmidt, și a fost în 1865. Ca rezultat al experimentelor sale, Loschmidt a ajuns la concluzia că într-un centimetru cub de orice gaz, în condiții obișnuite, există 2.68675 • 10 ^ 19 molecule.
Ulterior, a fost inventat un număr mare moduri independente de determinare a numărului lui Avogadro și deoarece rezultatele au coincis mai mult, aceasta a vorbit din nou în favoarea existenței reale a moleculelor. În prezent, numărul de metode a depășit 60 de ani, dar în ultimii ani oamenii de știință încearcă să îmbunătățească în continuare precizia evaluării pentru a introduce o nouă definiție a termenului "kilogram". Până în prezent, un kilogram este comparat cu standardul material ales fără o definiție fundamentală.
Cu toate acestea, permiteți-ne să ne întoarcem la întrebarea noastră - de ce este această constantă 6.022 • 10 ^ 23?
 În chimie, în 1973, pentru comoditate în calcule sa sugerat introducerea unei astfel de noțiuni ca "cantitatea de substanță". Unitatea de bază pentru măsurarea cantității a fost molia. În conformitate cu recomandările IUPAC, cantitatea oricărei substanțe este proporțională cu numărul particulelor sale elementare specifice. Coeficientul de proporționalitate nu depinde de tipul de substanță, iar numărul lui Avogadro este reciproc.
În chimie, în 1973, pentru comoditate în calcule sa sugerat introducerea unei astfel de noțiuni ca "cantitatea de substanță". Unitatea de bază pentru măsurarea cantității a fost molia. În conformitate cu recomandările IUPAC, cantitatea oricărei substanțe este proporțională cu numărul particulelor sale elementare specifice. Coeficientul de proporționalitate nu depinde de tipul de substanță, iar numărul lui Avogadro este reciproc.
Pentru claritate, să luăm un exemplu. După cum se știe din definiția unității de masă atomică, 1 amu. corespunde unei doisprezecimi din masa unui atom de carbon de 12C și este de 1,66053878 • 10 ^ (minus-24) grame. Dacă înmulțim 1 amu pe constanta lui Avogadro, atunci va fi de 1.000 g / mol. Acum să luăm câteva element chimic, spune, beriliu. Conform tabelului, masa unui atom de beriliu este de 9,01 amu. Să numărăm ce este un mol de atomi ai acestui element:
6,02 x 10 ^ 23 mol-1 * 1.66053878h10 ^ (minus 24) * 9.01 grame = 9.01 grame / mol.
Astfel, se pare că molară numeric coincide cu cel atomic.
Avogadro constant a fost ales special pentru ca masa molară să corespundă unei valori atomice sau dimensionale - relativă moleculară (atomică). Putem spune că numărul lui Avogadro este obligat să apariția lui pe de o parte, unitatea de masă atomică, iar pe de altă parte - o unitate comună pentru compararea greutate - grame.
 Legea lui Avogadro
Legea lui Avogadro Care este dimensiunea moleculelor? Care sunt dimensiunile moleculei?
Care este dimensiunea moleculelor? Care sunt dimensiunile moleculei? Concentrația de moleculă. Care este concentrația molară și molară?
Concentrația de moleculă. Care este concentrația molară și molară? În ce cazuri constanta de disociere nu are sens?
În ce cazuri constanta de disociere nu are sens? Masa moleculară a oxigenului. Care este masa molară de oxigen?
Masa moleculară a oxigenului. Care este masa molară de oxigen? Avogadro Amedeo este fondatorul teoriei moleculare
Avogadro Amedeo este fondatorul teoriei moleculare Perfect gaz. Ecuația de stare a unui gaz ideal. Izoprotsessy.
Perfect gaz. Ecuația de stare a unui gaz ideal. Izoprotsessy. Chimie: concepte de bază, definiții, termeni și legi
Chimie: concepte de bază, definiții, termeni și legi Densitatea aerului
Densitatea aerului Care este normalitatea soluției? Cum se determină normalitatea soluției? Formula pentru…
Care este normalitatea soluției? Cum se determină normalitatea soluției? Formula pentru…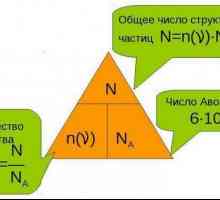 Care este cantitatea de materie și cum este determinată?
Care este cantitatea de materie și cum este determinată? Ce este o molie în chimie? Definiție și formule
Ce este o molie în chimie? Definiție și formule Chimiști celebri: biografii și realizări
Chimiști celebri: biografii și realizări Structura atomului
Structura atomului Miscarea Brownian: definiție. Miscarea Brownian - ce este?
Miscarea Brownian: definiție. Miscarea Brownian - ce este? Chimia este incitantă!
Chimia este incitantă! Masa moleculară a amoniacului, proprietăți, aplicare
Masa moleculară a amoniacului, proprietăți, aplicare Structura nucleului atomic: istoria studiului și caracteristicile moderne
Structura nucleului atomic: istoria studiului și caracteristicile moderne Mărimea moleculară: esența acestui indicator chimic, metode de determinare
Mărimea moleculară: esența acestui indicator chimic, metode de determinare Masa molară? Tabel pentru a ajuta!
Masa molară? Tabel pentru a ajuta! Masa moleculară a determinării aerului
Masa moleculară a determinării aerului
 Care este dimensiunea moleculelor? Care sunt dimensiunile moleculei?
Care este dimensiunea moleculelor? Care sunt dimensiunile moleculei? Concentrația de moleculă. Care este concentrația molară și molară?
Concentrația de moleculă. Care este concentrația molară și molară? Masa moleculară a oxigenului. Care este masa molară de oxigen?
Masa moleculară a oxigenului. Care este masa molară de oxigen? Avogadro Amedeo este fondatorul teoriei moleculare
Avogadro Amedeo este fondatorul teoriei moleculare Perfect gaz. Ecuația de stare a unui gaz ideal. Izoprotsessy.
Perfect gaz. Ecuația de stare a unui gaz ideal. Izoprotsessy. Chimie: concepte de bază, definiții, termeni și legi
Chimie: concepte de bază, definiții, termeni și legi Care este normalitatea soluției? Cum se determină normalitatea soluției? Formula pentru…
Care este normalitatea soluției? Cum se determină normalitatea soluției? Formula pentru…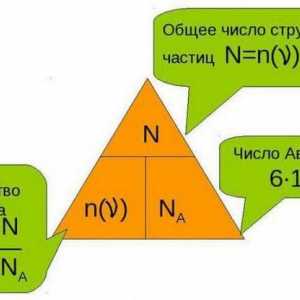 Care este cantitatea de materie și cum este determinată?
Care este cantitatea de materie și cum este determinată?