Descompunerea permanganatului de potasiu. Proprietăți ale sărurilor de acid manganos
Procesele de oxidare-reducere stau la baza celor mai importante fenomene de natură animată și neînsuflețită: arderea, descompunerea substanțelor complexe, sinteza compușilor organici. Permanganatul de potasiu, ale cărui proprietăți vom studia în articolul nostru, se referă la cei mai puternici oxidanți
conținut

Caracteristicile substanței
Compusul pe care îl considerăm (permanganatul de potasiu) este una dintre cele mai frecvent utilizate substanțe din industrie - compușii de mangan. Sarea este reprezentată de cristale sub formă de prisme regulate de culoare violet închis. Se dizolvă bine în apă și formează o soluție de culoare purpurie, care are caracteristici bactericide excelente. Prin urmare, substanța a găsit o aplicare largă atât în medicină, cât și în viața de zi cu zi ca agent bactericid. Ca și alți compuși ai manganului semivalent, sarea este capabilă să oxideze mulți compuși de natură organică și anorganică. Descompunerea permanganatului de potasiu este folosită în laboratoarele chimice pentru a produce volume mici de oxigen pur. Compusul oxidează acidul sulfitic în acid sulfat. În industria KMnO4 este utilizat pentru a separa clorul gazos de acidul clorhidric. De asemenea, oxidat majoritatea substanțelor organice, este capabil să transforme sărurile feroase în forma compușilor trivalenți ai săi.

Experimente cu permanganat de potasiu
Substanța, în viața de zi cu zi numită mangan, se descompune la încălzire. În produsele de reacție oxigenul liber, dioxidul de mangan și o nouă sare - K2MnO4. În laborator, acest proces este efectuat pentru a produce oxigen pur. Ecuația chimică de descompunere a permanganatului de potasiu poate fi reprezentată după cum urmează:
2KMnO4 = K2MnO4 + MnO2 + O2.
Substanța uscată, care este un cristal violet sub formă de prisme regulate, este încălzită la o temperatură de +200 ° C. Cationul de mangan, care este în sare, are o stare de oxidare de +7. Ea scade în produsele de reacție la valori de +6 și, respectiv, +4.

Oxidarea etilenei
Hidrocarburile gazoase aparținând diferitelor clase de compuși organici au atât legături unice cât și multiple între atomii de carbon din moleculele lor. Cum se determină prezența legăturilor pi, care stau la baza naturii nesaturate a compusului organic? Pentru aceasta, se efectuează experimente chimice prin trecerea substanței de testat (de exemplu, etenă sau acetilenă) prin purpuriu soluție de permanganat de potasiu. Decolorarea sa este observată, deoarece legătura nesaturată este distrusă. Molecula de etilenă este oxidată și, din hidrocarbură nesaturată, este transformată într-un alcool limitativ diatomic - etilen glicol. Această reacție este calitativă pentru prezența legăturilor duble sau triple.
Caracteristicile manifestărilor chimice ale KMnO4
Dacă starea de oxidare a reactanților și a produselor de reacție se schimbă, apare o reacție de reducere a oxidării. Se bazează pe fenomenul mișcării electronilor de la un atom la altul. Ca și în cazul descompunerii permanganatului de potasiu și în alte reacții, substanța prezintă proprietăți pronunțate ale oxidantului. De exemplu, într-o soluție acidă de sulfit de sodiu și permanganat de potasiu se formează sulfat de sodiu, potasiu și mangan, precum și apă:
5NA2SO3 + 2KMnO4 + 3H2SO4 = 2MnSO4 + 5NA2SO4 + K2SO4 + 3H20.
În acest caz, ionul de sulf este un agent reducător, iar manganul care intră în anionul complex MnO4-, arată proprietățile oxidantului. Este nevoie de cinci electroni, deci gradul de oxidare scade de la +7 la +2.
Influența mediului asupra cursului reacției chimice
În funcție de concentrația ionilor de hidrogen sau a grupărilor hidroxil, se disting natura acidă, alcalină sau neutră a soluției, în care are loc o reacție de reducere a oxidării. De exemplu, cu un conținut în exces de cationi de hidrogen, un ion de mangan cu o stare de oxidare de +7 în permanganat de potasiu îl scade la +2. Într-un mediu alcalin, cu o concentrație ridicată de grupe hidroxil, sulfitul de sodiu reacționează cu permanganatul de potasiu și este oxidat în sulfat. Ionul de mangan cu o stare de oxidare de +7 trece într-un cation cu o sarcină de +6, care este conținut în K2MnO4, a cărui soluție are o culoare verde. Într-un mediu neutru, sulfitul de sodiu și permanganatul de potasiu reacționează unul cu altul, în timp ce dioxidul de mangan precipită. Gradul de oxidare a cationului de mangan scade de la +7 la +4. În produsele de reacție, se găsesc de asemenea sulfat de sodiu și hidroxid de sodiu alcalin.

Utilizarea sărurilor de acid manganos
Reacția de descompunere permanganatul de potasiu sub încălzire și alte procese redox care implică săruri de mangan sunt adesea folosite în industrie. De exemplu, oxidarea multor compuși organici, eliberarea clorului gazos din acid clorhidric, conversia sărurilor feroase la trivalenți. În agricultură, soluția KMnO4 sunt utilizate pentru pre-tratarea semințelor și a solului, în medicină procesează suprafața plăgii, dezinfectează mucoasele inflamate ale cavității nazale și o folosesc pentru a dezinfecta elementele de igienă personală.
În acest articol, nu am studiat doar în detaliu procesul de descompunere a permanganatului de potasiu, dar, de asemenea, am examinat proprietățile sale oxidante și aplicațiile în viața cotidiană și în industrie.
 Care este reacția de descompunere în chimie? Exemple de reacție de descompunere
Care este reacția de descompunere în chimie? Exemple de reacție de descompunere Marea întrebare este: "De ce au interzis permanganatul?"
Marea întrebare este: "De ce au interzis permanganatul?" Care este aplicarea practică a permanganatului de potasiu? Să înțelegem
Care este aplicarea practică a permanganatului de potasiu? Să înțelegem Formula de oxigen. Tabelul periodic al lui Mendeleev - oxigen
Formula de oxigen. Tabelul periodic al lui Mendeleev - oxigen Cum se diluează permanganatul la consistența corectă
Cum se diluează permanganatul la consistența corectă Dicromat de potasiu
Dicromat de potasiu Proprietățile de reducere au ... Proprietățile Redox
Proprietățile de reducere au ... Proprietățile Redox Soluție de mangan - ambulanță la domiciliu.
Soluție de mangan - ambulanță la domiciliu. Ce este OVR în chimia modernă?
Ce este OVR în chimia modernă? Alegeți cei mai puternici oxidanți
Alegeți cei mai puternici oxidanți Sarea lui Bertoletov
Sarea lui Bertoletov Care este natura oxizilor
Care este natura oxizilor Metale alcaline
Metale alcaline Reacții de oxidare-reducere
Reacții de oxidare-reducere Proprietățile chimice și fizice, aplicarea și producerea oxigenului
Proprietățile chimice și fizice, aplicarea și producerea oxigenului Clorura de potasiu. Obținerea proprietăților chimice și fizice. cerere
Clorura de potasiu. Obținerea proprietăților chimice și fizice. cerere Oxizi de bază și proprietățile acestora
Oxizi de bază și proprietățile acestora Acid azotic. Proprietăți chimice și fizice
Acid azotic. Proprietăți chimice și fizice Valence de mangan. Proprietățile elementelor chimice
Valence de mangan. Proprietățile elementelor chimice Acid manganic: utilizare și proprietăți
Acid manganic: utilizare și proprietăți Oxizii. Exemple, clasificare, proprietăți
Oxizii. Exemple, clasificare, proprietăți
 Marea întrebare este: "De ce au interzis permanganatul?"
Marea întrebare este: "De ce au interzis permanganatul?" Care este aplicarea practică a permanganatului de potasiu? Să înțelegem
Care este aplicarea practică a permanganatului de potasiu? Să înțelegem Formula de oxigen. Tabelul periodic al lui Mendeleev - oxigen
Formula de oxigen. Tabelul periodic al lui Mendeleev - oxigen Cum se diluează permanganatul la consistența corectă
Cum se diluează permanganatul la consistența corectă Proprietățile de reducere au ... Proprietățile Redox
Proprietățile de reducere au ... Proprietățile Redox Ce este OVR în chimia modernă?
Ce este OVR în chimia modernă?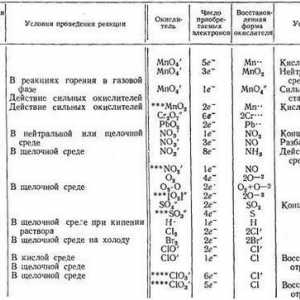 Alegeți cei mai puternici oxidanți
Alegeți cei mai puternici oxidanți