Ce depinde numărul de electroni din atom și de pe el?
De mult timp, multe proprietăți ale materiei au rămas un secret pentru cercetători. De ce unele substanțe conduc perfect energia electrică, în timp ce altele nu? De ce fierul se descompune treptat sub influența atmosferei, iar metalele nobile sunt perfect conservate de mii de ani? Multe dintre aceste întrebări au fost răspunsate după ce persoana a devenit conștientă de structura atomului: structura sa, numărul de electroni pe fiecare strat de electroni. Mai mult, stăpânirea chiar fundamentelor structurii nucleelor atomice a deschis o nouă eră pentru lume.
conținut
Din ce elemente este o cărămidă elementară construită din materie, cum interacționează cu ele, ce putem învăța din asta?
Structura atomului în reprezentarea științei moderne
În prezent, majoritatea oamenilor de știință sunt înclinați să adere la modelul planetar al structurii materiei. Conform acestui model, în centrul fiecărui atom există un nucleu, unul mic, chiar în comparație cu un atom (este de zeci de mii de ori mai mic decât un atom întreg). Dar masa miezului nu este așa. Practic, întreaga masă a atomului este concentrată în nucleu. Nucleul este încărcat pozitiv.

În jurul nucleului, electronii se rotesc în orbite diferite, nu circulară, ca în cazul planetelor sistemului solar, ci volumetrice (sfere și optimi voluminoase). Numărul de electroni dintr-un atom este numeric egal cu sarcina nucleului. Dar pentru a vedea un electron ca o particulă care se mișcă de-a lungul unei traiectorii este foarte dificilă.

Orbita sa este mică și viteza este aproape ca un fascicul de lumină, deci este mai corect să tratăm un electron împreună cu orbita sa ca un fel de sferă încărcată negativ.
Membrii Familiei Atomice
Toți atomii constau din 3 elemente constitutive: protoni, electroni și neutroni.
Protonul este principalul material de construcție al nucleului. Greutatea sa este egală cu unitatea atomică (masa atomului de hidrogen) sau 1,67 ∙ 10-27 kg în sistemul SI. Particula este încărcată pozitiv, iar sarcina sa este luată ca unitate într-un sistem de sarcini electrice elementare.
Neutronul este un gemene de protoni în masă, dar nu este încărcat deloc.
Cele două particule enumerate mai sus se numesc nuclide.
Electronul este protonul opus în sarcină (încărcarea elementară este minus-1). Dar aici greutatea electronului a fost pompată, masa fiind de numai 9,12 ∙ 10-31 kg, care este de aproape 2000 de ori mai ușoară decât un proton sau un neutron.
Cum au "văzut"
Cum a fost posibilă stabilirea structurii atomului, chiar dacă mijloacele tehnice cele mai avansate nu permit acest lucru și pe termen scurt nu vor permite obținerea imaginilor particulelor sale constituente. Cum știau oamenii de știință numărul de protoni, neutroni și electroni din nucleu și locația lor?
Presupunerea unui aranjament planetar de atomi a fost făcută pe baza rezultatelor bombardamentului unei folii metalice subțiri de particule diferite. Figura arată clar cât de diferite particule elementare interacționează cu materia.

Numărul de electroni care au trecut prin metal a fost zero în experimente. Acest lucru este explicat pur și simplu: electronii încărcați negativ resping din cochilii de electroni din metal, care au și o încărcare negativă.
Un fascicul de protoni (încărcare +) a trecut prin folie, dar cu "pierderi". Partea a fost respinsă de nucleele prinse pe drum (probabilitatea unor astfel de lovituri este foarte mică), partea sa deviată de la traiectoria originală, zburând prea aproape de unul dintre nuclee.
Cele mai "eficiente" în ceea ce privește depășirea metalelor au fost neutronii. Particulele încărcate neutru s-au pierdut doar în cazul unei coliziuni directe cu miezul substanței, 99,99% din neutronii trecând în siguranță prin grosimea metalului. Apropo, dimensiunea nucleelor acestor sau a altor elemente chimice ar putea fi calculată tocmai pe baza numărului de neutroni de la intrare și nu de ieșire.
Pe baza datelor obținute, sa construit teoria dominantă a structurii materiei, care explică cu succes majoritatea întrebărilor.
Ce și cât de mult
Numărul de electroni dintr-un atom depinde de numărul ordinal. Deci, în atomul de hidrogen obișnuit, există doar un proton. Un singur electron se rotește pe orbită. Următorul element al tabelului periodic - heliul este puțin mai complicat. Miezul său constă din doi protoni și doi neutroni și are astfel o masă atomică 4.
Pe măsură ce numărul ordinal crește, dimensiunea și masa atomului cresc. Numărul ordinal al elementului chimic din tabelul periodic corespunde sarcinii nucleare (numărul de protoni din ea). Numărul de electroni dintr-un atom este egal cu numărul de protoni. Astfel, atomul de plumb (numărul ordinal 82) are 82 de protoni în nucleul său. Pe orbitele din jurul nucleului există 82 de electroni. Pentru a calcula numărul de neutroni din nucleu, este suficient să se ia departe de numărul de masă atomică de protoni:
207 - 82 = 125.
De ce sunt întotdeauna cincizeci și cinci
Orice sistem din universul nostru se străduiește pentru stabilitate. Aplicată la atom, acest lucru este exprimat în neutralitatea sa. Dacă ne imaginăm pentru un moment că toți atomii din Univers, fără excepție, au o sarcină diferită de dimensiuni diferite cu semne diferite, se poate imagina care ar fi haosul din lume.

Dar, deoarece numărul de protoni și electroni dintr-un atom este egal, sarcina finală a fiecărei "cărămizi" este zero.
Numărul de neutroni din atom este o cantitate independentă. Mai mult decât atât, atomii din același element chimic pot avea un număr diferit de aceste particule cu încărcare zero. exemplu:
- 1 proton + 1 electron + 0 neutroni = hidrogen (masa atomică 1);
- 1 proton + 1 electron + 1 neutron = deuteriu (masa atomică 2);
- 1 proton + 1 electron + 2 neutroni = tritiu (masa atomică 3).
În acest caz, numărul de electroni din atom nu se schimbă, atomul rămâne neutru, masa se schimbă. Astfel de variații ale elementelor chimice sunt denumite în mod obișnuit izotopi.
Atomul este întotdeauna neutru?
Nu, nu întotdeauna numărul de electroni dintr-un atom este egal cu numărul de protoni. Dacă un atom nu ar putea "scoate" un electron de-a lungul timpului, nu ar mai fi un lucru galvanic. Pe un atom, ca orice lucru, puteți lucra.
Sub influența unui câmp electric suficient de puternic din stratul exterior al unui atom, unul sau mai mulți electroni pot zbura. În acest caz, o particulă de materie încetează să mai fie neutră și se numește ion. Se poate deplasa într-un mediu gazos sau lichid, purtând o sarcină electrică de la un electrod la altul. Astfel se depozitează încărcătura electrică a bateriilor și se depun cele mai fine filme realizate dintr-un metal pe suprafața altora (aurire, argintare, placare cu crom, placare cu nichel etc.).

Numărul de electroni este, de asemenea, instabil în metalele-conductoare de curent electric. Electronii straturilor exterioare, așa cum au fost, merg de la atom la atom, purtând energie electrică de-a lungul conductorului.
 Electronii sunt ce? Proprietățile și istoria descoperirii electronilor
Electronii sunt ce? Proprietățile și istoria descoperirii electronilor Modele ale atomilor lui Thomson și Rutherford pentru scurt timp
Modele ale atomilor lui Thomson și Rutherford pentru scurt timp Ce este o particulă subatomică?
Ce este o particulă subatomică? Ce particulă elementară are o încărcătură pozitivă?
Ce particulă elementară are o încărcătură pozitivă? Compoziția nucleului atomului. Nucleul unui atom
Compoziția nucleului atomului. Nucleul unui atom Modelul planetar al lui Rutherford, atom în modelul Rutherford
Modelul planetar al lui Rutherford, atom în modelul Rutherford Momentul descoperirilor științifice - principiul Pauli
Momentul descoperirilor științifice - principiul Pauli Structura atomului. Modelul cuantic-mecanic al unui atom
Structura atomului. Modelul cuantic-mecanic al unui atom Nucleul atomic. Descoperirea unor secrete
Nucleul atomic. Descoperirea unor secrete Să vorbim despre cum să găsim protoni, neutroni și electroni
Să vorbim despre cum să găsim protoni, neutroni și electroni Informații de bază despre structura atomului: caracteristici, trăsături și formulă
Informații de bază despre structura atomului: caracteristici, trăsături și formulă Cine a propus modelul nuclear al structurii atomului? Modelul nuclear al structurii atomice și…
Cine a propus modelul nuclear al structurii atomului? Modelul nuclear al structurii atomice și… Experiența lui Rutherford
Experiența lui Rutherford Ce sunt electronii de valență?
Ce sunt electronii de valență? Care este starea excitat a unui atom
Care este starea excitat a unui atom Ce este degradarea alfa?
Ce este degradarea alfa? Energia de ionizare a unui atom
Energia de ionizare a unui atom Pe scurt despre complex: structura nucleelor de electroni ale atomilor
Pe scurt despre complex: structura nucleelor de electroni ale atomilor Modelul planetar al atomului: justificarea teoretică și dovezile practice
Modelul planetar al atomului: justificarea teoretică și dovezile practice De ce constă atomul unei substanțe?
De ce constă atomul unei substanțe? Configurația electronică - secretele structurii atomului
Configurația electronică - secretele structurii atomului
 Modele ale atomilor lui Thomson și Rutherford pentru scurt timp
Modele ale atomilor lui Thomson și Rutherford pentru scurt timp Ce este o particulă subatomică?
Ce este o particulă subatomică? Ce particulă elementară are o încărcătură pozitivă?
Ce particulă elementară are o încărcătură pozitivă? Compoziția nucleului atomului. Nucleul unui atom
Compoziția nucleului atomului. Nucleul unui atom Modelul planetar al lui Rutherford, atom în modelul Rutherford
Modelul planetar al lui Rutherford, atom în modelul Rutherford Structura atomului. Modelul cuantic-mecanic al unui atom
Structura atomului. Modelul cuantic-mecanic al unui atom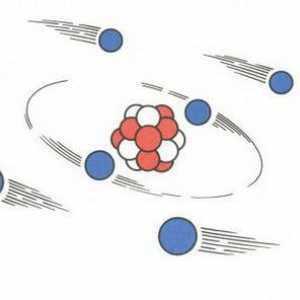 Să vorbim despre cum să găsim protoni, neutroni și electroni
Să vorbim despre cum să găsim protoni, neutroni și electroni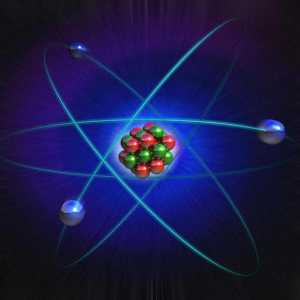 Informații de bază despre structura atomului: caracteristici, trăsături și formulă
Informații de bază despre structura atomului: caracteristici, trăsături și formulă