Amoniu este un ion de interacțiune donor-acceptor
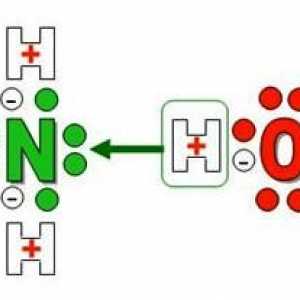
Amoniacul este un gaz care are o solubilitate excelentă în apă: într-un litru se poate dizolva până la 700 litri de compus gazos. Ca urmare, se formează nu numai hidrat de amoniac, ci și particule de grupe hidroxilice, precum și amoniu. Acesta este un ion care provine din interacțiunea dintre moleculele de gaz și protonii de hidrogen care se separă de apă. În acest articol vom examina proprietățile și aplicațiile sale în industrie, medicină și viața de zi cu zi.
conținut

Cum se formează particule de amoniu
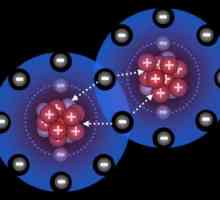
Unul dintre cele mai comune tipuri de legături chimice, caracteristice atât pentru compușii anorganici cât și pentru substanțele organice, este legătura covalentă. Aceasta poate fi formată fie prin nopți de electroni care se suprapun, având tipul spin-spin opus, fie prin intermediul mecanismului donor-acceptor. În acest mod, se formează amoniu, formula fiind NH4+. În acest caz, legătura chimică se formează cu ajutorul unei orbite libere a unui atom și a unui nor de electroni care conține doi electroni. Azotul furnizează ionul cu propria pereche de particule negative, iar protonul de hidrogen are o orbită liberă de 1s. La momentul apropierii norului electronic două azot devine comun la acesta și H. atom O astfel de structură este numită nori de electroni moleculare, care este format în a patra legătură covalentă.
Mecanism donator-acceptor
O particulă care furnizează o pereche de electroni este numită donator, dar un atom neutru care dă o celulă electronică goală un acceptor. Legătura formată se numește donator-acceptor sau coordonator, fără a uita că este un caz particular al legăturii covalente clasice. În ionul de amoniu, a cărui formulă este NH4+, conține patru legături covalente. Dintre acestea, trei, combinând atomii de azot și hidrogen, sunt speciile covalente obișnuite, iar ultima este o legătură de coordonare. Cu toate acestea, toate cele patru specii sunt absolut echivalente. În mod similar, există o interacțiune între moleculele de apă și Cu2+. În acest caz, se formează o macromolecule de sulfat de hidrat de cupru.

Sare de amoniu: proprietăți și preparare
În reacția de adiție, interacțiunea dintre ionul de hidrogen și amoniac are ca rezultat formarea unui NH4+. Molecula NH3 se comportă ca un acceptor, prin urmare are proprietăți pronunțate ale bazei. Reacția cu acizi anorganici duce la apariția moleculelor de săruri: clorură, sulfat, azotat de amoniu.
NH3 + HCI = NH4CI
Procesul de dizolvare a amoniacului în apă conduce, de asemenea, la formarea unui ion de amoniu, a cărui producție poate fi exprimată prin ecuația:
NH3 + H2O = NH4+ + OH-
Ca o consecință, în soluția apoasă de amoniac, numită și hidroxid de amoniu, crește concentrația particulelor de hidroxil. Aceasta conduce la faptul că reacția mediului devine alcalină. Puteți să o determinați cu ajutorul unui indicator - phenolphthalein, care își schimbă culoarea de la incolor la purpuriu. Majoritatea compușilor au aspectul de substanțe cristaline incolore care sunt foarte solubile în apă. În multe dintre manifestările lor se aseamănă cu sărurile metalelor active: litiu, sodiu, rubidiu. Cele mai mari asemănări se regăsesc între sărurile de potasiu și amoniu. Acest lucru se explică prin dimensiunile apropiate ale razei de potasiu și NH4+. Când se încălzesc, se descompun pentru a forma amoniac gazos.
NH4CI = NH3 + HCI

Reacția este reversibilă, deoarece produsele sale pot reacționa din nou unul cu celălalt pentru a forma o sare de amoniu. Când soluția de clorură de amoniu, NH3 evapora imediat, astfel încât să puteți miroși amoniacul. Prin urmare, o reacție calitativă la ionul de amoniu este descompunerea termică a sărurilor sale.
hidroliză
Apa de amoniac prezintă proprietăți ale unei baze slabe, astfel încât sărurile care conțin particule de NH4+, trece procesul de schimb cu apă - hidroliză. Soluțiile de clorură sau de sulfat de amoniu au o reacție slabă acidă, deoarece acumulează o cantitate excesivă de cationi de hidrogen. Dacă le adăugați un alcalin, de exemplu, hidroxidul de sodiu, atunci particulele de hidroxil se vor lega de protonii de hidrogen pentru a forma molecule de apă. De exemplu, hidroliza clorurii de amoniu este o reacție de schimb între sare și apă, conducând la formarea unui electrolit slab - NH4OH.

Caracteristici ale descompunerii termice a sărurilor de amoniu
Majoritatea compușilor din acest grup formează o amoniac gazos când este încălzit, procesul în sine este reversibil. Cu toate acestea, în cazul în care sarea are proprietăți oxidante puternice, de exemplu, se referă la o astfel de azotat de amoniu, atunci când este încălzit, este ireversibil descompus la monoxid de azot și apă. Această reacție este redox, în care ionul de amoniu este un agent reducător, iar anionul reziduului acid al acidului nitrat este un agent de oxidare.
Importanța compușilor de amoniac
Atât amoniacul gazos cât și majoritatea sărurilor sale au o gamă largă de aplicații în industrie, agricultură, medicină și viața de zi cu zi. La o presiune mică (de ordinul a 7-8 atm), gazul lichefiază rapid, absorbind o cantitate mare de căldură. Prin urmare, este utilizat în instalațiile de refrigerare. În laboratoarele chimice, hidroxidul de amoniu este utilizat ca bază volatilă slabă pentru pilot, adecvată pentru experimente. Cea mai mare parte a amoniacului este utilizat pentru producerea acidului azotic și solea - îngrășăminte minerale importante - salpetru. Conținutul înalt de azot este ridicat de azotat de amoniu. Se folosește și în pirotehnică și în lucrări subversive pentru fabricarea de explozivi - amonali. Amoniac, clorură de amoniu fiind găsit aplicarea în celule electrochimice, la fabricarea țesăturilor din bumbac, procese de lipit din metal.

Substanța în acest caz accelerează procesele de eliminare a filmelor de oxid pe suprafața metalică, care devin cloruri sau sunt reduse. În medicină, amoniacul, care are un miros ascuțit, este folosit ca remediu pentru a restabili conștiința după starea de leșin a pacientului.
În acest articol, am examinat proprietățile și aplicarea hidroxidului de amoniu și a sărurilor sale în diverse industrii și medicină.
 Mecanismul donator-acceptor: exemple. Ce este un mecanism donator-acceptor?
Mecanismul donator-acceptor: exemple. Ce este un mecanism donator-acceptor?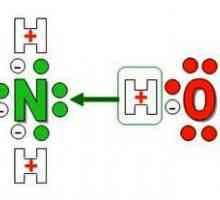 Apă de amoniac: preparat, formulă, aplicare
Apă de amoniac: preparat, formulă, aplicare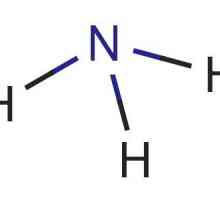 Formula de amoniac. Hidroxidul de amoniu este o soluție apoasă de amoniac
Formula de amoniac. Hidroxidul de amoniu este o soluție apoasă de amoniac Amoniacul. Proprietăți chimice, caracteristici fizice. Aplicare și recepție
Amoniacul. Proprietăți chimice, caracteristici fizice. Aplicare și recepție Soluție de amoniac - preparare și aplicare
Soluție de amoniac - preparare și aplicare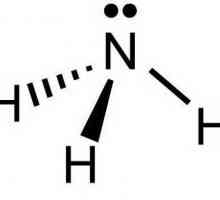 Ce este amoniacul? Formula și proprietățile amoniacului
Ce este amoniacul? Formula și proprietățile amoniacului Monoxid de carbon: Formula și proprietățile
Monoxid de carbon: Formula și proprietățile Carbonat de amoniu
Carbonat de amoniu Sare de amoniu - metode de producție, utilizare în economia națională
Sare de amoniu - metode de producție, utilizare în economia națională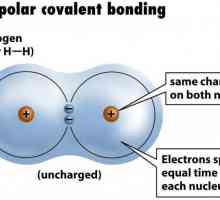 Un exemplu de legătură covalentă nepolară. Legătura covalentă este polară și nepolară
Un exemplu de legătură covalentă nepolară. Legătura covalentă este polară și nepolară Sulfuri și hidrosulfuri. Hidrosulfură și sulfură de amoniu
Sulfuri și hidrosulfuri. Hidrosulfură și sulfură de amoniu Sare. Bicarbonat de amoniu
Sare. Bicarbonat de amoniu Azotat de amoniu
Azotat de amoniu Legătura donor-acceptor: exemple de substanțe
Legătura donor-acceptor: exemple de substanțe Caracteristicile legăturii covalente. Pentru care substanțele este o legătură covalentă
Caracteristicile legăturii covalente. Pentru care substanțele este o legătură covalentă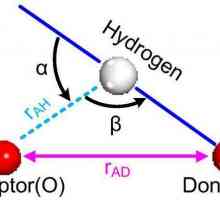 Legătura cu hidrogen: exemple și tipuri de legături chimice
Legătura cu hidrogen: exemple și tipuri de legături chimice Principalele tipuri de legături chimice: de ce și cum sunt formate
Principalele tipuri de legături chimice: de ce și cum sunt formate Ce este o legătură de hidrogen? Tipuri, influență
Ce este o legătură de hidrogen? Tipuri, influență Legarea ionilor
Legarea ionilor Masa moleculară a amoniacului, proprietăți, aplicare
Masa moleculară a amoniacului, proprietăți, aplicare Legătura chimică: definiția, tipurile, clasificarea și caracteristicile definiției
Legătura chimică: definiția, tipurile, clasificarea și caracteristicile definiției
 Apă de amoniac: preparat, formulă, aplicare
Apă de amoniac: preparat, formulă, aplicare Formula de amoniac. Hidroxidul de amoniu este o soluție apoasă de amoniac
Formula de amoniac. Hidroxidul de amoniu este o soluție apoasă de amoniac Ce este amoniacul? Formula și proprietățile amoniacului
Ce este amoniacul? Formula și proprietățile amoniacului Monoxid de carbon: Formula și proprietățile
Monoxid de carbon: Formula și proprietățile Un exemplu de legătură covalentă nepolară. Legătura covalentă este polară și nepolară
Un exemplu de legătură covalentă nepolară. Legătura covalentă este polară și nepolară