Ordinea de reacție: concept, tipuri
În cinetica chimică, una dintre sarcinile importante este de a găsi ordinea reacției. Deși această valoare este de asemenea formală, ea permite cea mai bună modalitate de a reflecta dependența experimentală a ratei oricărei reacții asupra concentrației. Ca regulă, pentru a găsi viteza de reacție, se folosesc concentrațiile compușilor inițiali luați în grade corespunzătoare coeficienților lor stoechiometrici. Dar acest lucru este valabil doar pentru reacțiile foarte simple.
conținut
Ordinea reacției chimice asupra substanței este valoarea gradului n, în care concentrația acestui compus intră în formula pentru a găsi viteza de reacție obținută experimental. Dar ordinea generală este suma tuturor ordinelor pentru substanțe: n = n1 + n2. Valorile n1 și n2 corespund coeficienților stoichiometrici în ecuațiile reacțiilor într-o singură etapă. De fapt, ele pot avea valori pozitive sau negative, sunt numere întregi sau fracționate.
De exemplu, pentru ecuația de interacțiune H2+ iota-2 -> 2HIota-, care corespunde formulei de determinare a vitezei v = kCHCeu, ordinele pentru substanțe sunt nH= 1 și neu= 1, ordinea generală a reacției este n = nH+neu= 1 + 1 = 2.

Ordinul Zeroth
Unele reacții au un ordin de reacție zero. De regulă, acestea nu sunt afectate de concentrațiile compușilor inițiali. Acest lucru se întâmplă în următoarele cazuri:
- dacă orice material de pornire este luat în exces substanțial;
- dacă viteza este reglată de energia de activare a moleculelor care participă la reacție, de exemplu, în fotosinteză.
Ca exemplu, luați în considerare reacția acetatului de etil cu apă, adică saponificarea sa.
SEta-3SEA2Eta-5 + Eta-2О -> СЕта-3COOta + C2Eta-5OΗ
Deoarece solubilitatea mutuală a substanțelor inițiale este extrem de mică, masa lor principală este în diferite faze. Atunci când eterul este consumat într-o reacție chimică, o nouă porțiune a acestuia ajunge în timp util din stratul eteric, adică concentrația sa în soluție nu scade.
Reacții de ordinul întâi
O astfel de interacțiune a substanțelor poate fi condiționată în mod condiționat de ecuația: A -> B. Un exemplu este descompunerea dimetil eterului:
SEta-3OSEta-3-> CEa-4+Eta-2+CO
Pentru care viteza de reacție este definită ca v = kCS2N6O. În acest caz, ordinea substanței și a totalului ordinea este aceeași și sunt egale cu unul.
Valoarea practică pentru reacțiile de prim ordin are timpul (tau-) de determinare a unei anumite concentrații C, dacă concentrația inițială Cdespre, precum și timpul de înjumătățire plasmatică tau-1/2, acesta este timpul în care jumătate din materia primă are timp să reacționeze.

Reacții secundare
Astfel de reacții includ reacții ca produsele A + B ->. Un exemplu este reacția menționată mai sus pentru producerea de iodură de hidrogen sau saponificarea alcalină a acetatului de etil:
SEta-3SEA2H5 + Ota-- -> CH3СОО- + С2H5Ota-, v = kCS4N8O2COH.
De asemenea, (k) al doilea ordin este separat reacții de descompunere tip: 2A -> produse. Exemplele includ următoarele:
- 2NOCI -> 2NO + Cl2, v = kC2NOCl.
- 2O3 -> 3O2, v = kC2O3.
- 2NO2 -> 2NO + O2, v = kC2NO2.

Reacții ulterioare
Reacțiile ordinelor trei și ulterioare sunt mai puțin frecvente decât versiunile anterioare. Aceasta se datorează probabilității scăzute de apariție simultană în spațiu a trei sau mai multe particule. Cu toate acestea, un exemplu de astfel de interacțiuni poate fi formarea dioxidului de azot și a carbonului din monoxidurile lor:
- 2NOmicron- + Omicron-2→ 2NOmicron-2, v = kC2NUCO2.
- 2CO + O2→ 2СО2, v = kC2COCO2.
Pentru astfel de reacții, există, de asemenea, o dependență a concentrațiilor reactivului în momentul desfășurării acestuia. Formulele pentru determinarea semiperioadă și constantele de viteză de reacție sunt unificate prin introducerea unui indice n, egal cu ordinea acestor aceleași reacții.

Molecularitatea reacției
Nu confunda ordinea reacției cu moleculare sale, care este determinată de numărul de molecule care efectueaza actul de transformare chimică. Spre deosebire de ordinea, care este determinată experimental, natura moleculară a reacției chimice are o bază teoretică. Pentru a determina este necesar să se înțeleagă esența procesului exact cum moleculele interacționează unele cu altele, prin care trec etapa de conversie.
| Ordinul | molecularity |
| Valoarea formală | Există un înțeles fizic, arată numărul de molecule care reacționează |
| Pot lua valori numerice diferite | Acceptă numai una din cele trei valori: 1,2,3 |
| Se aplică la reacții de orice complexitate și în mai multe etape | Se aplică doar reacțiilor elementare în un singur pas |
Există mai multe motive pentru care ordinea și moleculația nu coincid pentru aceeași reacție:
- dacă unul dintre reactivi este luat într-un exces mare, așa cum s-a menționat mai sus;
- pentru multe reacții eterogene, ordinea se poate schimba în timpul implementării lor, mai ales dacă se schimbă condițiile de trecere a acestora;
- reacțiile catalitice au un mecanism în mai multe etape, esența căruia nu este întotdeauna reflectat de ecuația stoichiometrică;
- Reacțiile multistep complicate doar poate afecta valoarea totală a vitezei intermediare, care, ca rezultat va determina ordinea tuturor transformărilor.
Reacțiile monomoleculare includ descompunerea moleculelor:
eu2 -> 2I
În reacțiile bimoleculare, două molecule se ciocnesc. Și pot fi molecule de substanțe diferite, și același lucru:
H2+ iota-2 -> 2HI
Trimoleculară se referă la astfel de reacții, pentru implementarea cărora sunt necesare trei molecule ale substanțelor inițiale:
2NOmicron- + H2 -> N2Omicron- + H2oh
H2 + oh2 -> 2H2oh
 Reacția compusului: Exemple și formule
Reacția compusului: Exemple și formule Sisteme eterogene sau heterogene
Sisteme eterogene sau heterogene Principiul Le Chatelier: o descoperire științifică a secolului al XVIII-lea
Principiul Le Chatelier: o descoperire științifică a secolului al XVIII-lea Reacții omogene.
Reacții omogene. Căldură de învățământ este ceea ce?
Căldură de învățământ este ceea ce? Cum se compune o ecuație chimică: reguli, exemple. Înregistrarea reacției chimice
Cum se compune o ecuație chimică: reguli, exemple. Înregistrarea reacției chimice Cum se obține de la etancloroetan în chimia organică
Cum se obține de la etancloroetan în chimia organică Centrul activ al enzimei: structura, proprietățile. Cine a descoperit centrul activ al enzimei? Ce…
Centrul activ al enzimei: structura, proprietățile. Cine a descoperit centrul activ al enzimei? Ce… Ecuațiile chimice: cum să rezolve cel mai eficient
Ecuațiile chimice: cum să rezolve cel mai eficient Reacția interacțiunii dintre CaCl2, H2SO4
Reacția interacțiunii dintre CaCl2, H2SO4 Dependența ratei de reacție la temperatură. Ecuația lui Arrhenius
Dependența ratei de reacție la temperatură. Ecuația lui Arrhenius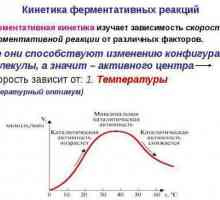 Kinetica reacțiilor enzimatice - descriere, caracteristici și tabel
Kinetica reacțiilor enzimatice - descriere, caracteristici și tabel Clasificarea reacțiilor chimice
Clasificarea reacțiilor chimice Ce este energia lui Gibbs?
Ce este energia lui Gibbs? Energie de activare
Energie de activare Factorii care afectează rata de reacție chimică
Factorii care afectează rata de reacție chimică Cum să aranjăm coeficienții în ecuațiile chimice? Ecuatii chimice
Cum să aranjăm coeficienții în ecuațiile chimice? Ecuatii chimice Echilibrul chimic: cum este trecerea
Echilibrul chimic: cum este trecerea O reacție catalitică este ce? Principii și tipuri de bază
O reacție catalitică este ce? Principii și tipuri de bază Ecuația reacției chimice - înregistrarea reacției chimice condiționate
Ecuația reacției chimice - înregistrarea reacției chimice condiționate Fracția de masă? Și care dintre ele?
Fracția de masă? Și care dintre ele?
 Căldură de învățământ este ceea ce?
Căldură de învățământ este ceea ce? Cum se compune o ecuație chimică: reguli, exemple. Înregistrarea reacției chimice
Cum se compune o ecuație chimică: reguli, exemple. Înregistrarea reacției chimice Cum se obține de la etancloroetan în chimia organică
Cum se obține de la etancloroetan în chimia organică Centrul activ al enzimei: structura, proprietățile. Cine a descoperit centrul activ al enzimei? Ce…
Centrul activ al enzimei: structura, proprietățile. Cine a descoperit centrul activ al enzimei? Ce… Ecuațiile chimice: cum să rezolve cel mai eficient
Ecuațiile chimice: cum să rezolve cel mai eficient Reacția interacțiunii dintre CaCl2, H2SO4
Reacția interacțiunii dintre CaCl2, H2SO4 Dependența ratei de reacție la temperatură. Ecuația lui Arrhenius
Dependența ratei de reacție la temperatură. Ecuația lui Arrhenius