Cum să aranjăm coeficienții în ecuațiile chimice? Ecuatii chimice
Astăzi vom vorbi despre modul de stabilire a coeficienților în ecuațiile chimice. Această problemă este de interes nu numai pentru elevii de vârf din instituțiile de învățământ general, dar și pentru copiii care cunosc doar elementele de bază ale unei științe complexe și interesante. Dacă în prima etapă, cum să faci ecuații chimice,
conținut
Ce este Ecuația
Se obișnuiește să se înțeleagă o înregistrare condiționată a unei reacții chimice între reactivii selectați. Pentru un astfel de proces, se folosesc indicii, coeficienții și formulele.
Algoritmul compilării
Cum de a proiecta ecuatii chimice? Exemple de interacțiuni pot fi scrise prin însumarea compușilor originali. Semnul de egalitate indică faptul că există o interacțiune între substanțele care reacționează. În continuare se face formula produselor pe valență (grad de oxidare).
Cum se înregistrează o reacție
De exemplu, dacă doriți să scrieți ecuații chimice care confirmă proprietățile metanului, alegeți următoarele opțiuni:
- halogenarea (interacțiunea radicală cu elementul VIIA din tabelul periodic al DI Mendeleev);
- combustie în oxigenul aerului.

Pentru primul caz pe partea stângă scriem substanțele inițiale, în dreapta obținem produsele. După verificarea numărului de atomi din fiecare element chimic, obținem înregistrarea finală a procesului. Când ard metanul în oxigenul de aer, are loc un proces exotermic, care are ca rezultat formarea dioxidului de carbon și a vaporilor de apă.
Pentru a pune corect coeficienții în ecuațiile chimice, se folosește legea conservării masei de substanțe. Începem procesul de egalizare cu determinarea numărului de atomi de carbon. Apoi, efectuăm calcule pentru hidrogen și numai apoi verificați cantitatea de oxigen.
WRA
Ecuațiile chimice complexe pot fi asimilate, înarmate cu metoda echilibrului electronic sau a jumătății de reacție. Propunem o serie de acțiuni menite să aranjeze coeficienții în reacțiile următoarelor tipuri:
- descompunere;
- substituție.

Mai întâi, este important să se plaseze fiecare componentă de oxidare în compus. Atunci când sunt aranjate, este necesar să se ia în considerare anumite reguli:
- Pentru o substanță simplă, este zero.
- Într-un compus binar, suma lor este 0.
- Într-un compus de trei sau mai multe elemente, prima prezintă o valoare pozitivă, ionul extrem are o valoare negativă a gradului de oxidare. Elementul central este calculat matematic, având în vedere că suma ar trebui să fie 0.
Mai mult, acești atomi sau ioni sunt selectați, în care indicele de oxidare sa schimbat. Semnele "plus" și "minus" indică numărul de electroni (primit, dat). Mai mult, cel mai mic număr este determinat între ele. Atunci când împărțiți LCM cu aceste numere, se obțin numere. Acest algoritm va fi răspunsul la întrebarea cum să aranjăm coeficienții în ecuațiile chimice.
Primul exemplu
Să presupunem că sarcina este dată: "Plasați coeficienții în reacție, completați golurile, determinați agentul de oxidare și agentul reducător." Astfel de exemple sunt oferite absolvenților de școală care au ales chimia ca examen.
KMnO4 + H2SO4 + KBr = MnSO4 + br2 +hellip- + ...

Să încercăm să înțelegem cum să stabilim coeficienții în ecuațiile chimice oferite viitorilor ingineri și medici. După plasarea elementelor în gradul de oxidare în materiile prime și produsele disponibile obținem că acționează ca un ion agent mangan oxidant, și prezintă o reducere a proprietăților de ioni de bromură.
Concluzionăm că substanțele pierdute nu participă la procesul de oxidare-reducere. Unul dintre produsele lipsă este apa, iar al doilea este sulfatul de potasiu. După compilarea balanței electronice, pasul final va fi formularea coeficienților din ecuație.
Cel de-al doilea exemplu
Să dăm un exemplu suplimentar pentru a înțelege cum să stabilim coeficienții în ecuațiile chimice ale tipului de oxidare-reducere.
Să presupunem că este dată următoarea schemă:
P + HNO3 = NO2 +hellip-+hellip-
Fosforul, care prin convenție este o substanță simplă, prezintă proprietăți de reducere, crescând gradul de oxidare la +5. Prin urmare, una dintre substanțele pierdute este acidul fosforic H3PO4. OVR presupune prezența unui agent reducător, care va acționa cu azot. Se trece în oxid nitric (4), formând NO2

Pentru a pune coeficienții în această reacție, vom compila un echilibru electronic.
P0 dă 5e = P+5
N+5 ia e = N+4
Având în vedere că înainte ca acidul azotic și oxidul nitric (4) să fie un coeficient de 5, vom obține o reacție gata:
P + 5HNO3 = 5NO2 + H2O + H3PO4
Coeficienții stereochimici în chimie ne permit să rezolvăm o varietate de probleme de calcul.
Cel de-al treilea exemplu
Având în vedere că aranjarea coeficienților provoacă dificultăți pentru mulți liceeni, este necesar să se elaboreze o serie de acțiuni pe exemple specifice. Oferim încă un exemplu al sarcinii, realizarea căruia presupune posesia metodei de aranjare a coeficienților în reacția de reducere a oxidării.
H2S + HMnO4 = S + MnO2+hellip-

Particularitatea sarcinii propuse este că este necesar să se completeze produsul de reacție ratat și numai după aceea este posibilă continuarea formulării coeficienților.
După aranjarea stărilor de oxidare pentru fiecare element din compuși, se poate concluziona că proprietățile de oxidare prezintă mangan care scade valența. Reducerea reacției propuse demonstrează sulful, recuperând o substanță simplă. După compilarea balanței electronice, va trebui să plasăm doar coeficienții în schema propusă a procesului. Și sa terminat.
Al patrulea exemplu
O ecuație chimică se numește un proces complet în cazul în care legea conservării masei de substanțe este respectată pe deplin în ea. Cum să testați acest model? Numărul atomilor dintr-o specie care a intrat în reacție trebuie să corespundă numărului lor în produsele de interacțiune. Numai în acest caz va fi posibil să se vorbească despre utilitatea interacțiunii chimice înregistrate, despre posibilitatea utilizării acesteia pentru calcule și despre rezolvarea problemelor computaționale de complexitate variată. Să dăm o variantă a sarcinii, care presupune dispunerea coeficienților stereochimici lipsă în reacție:
Si + hellip + HF = H2Sif6 + NU + ...

Complexitatea sarcinii este că atât materiile prime, cât și produsele de interacțiune sunt omise. După setarea tuturor elementelor stărilor de oxidare, vedem că atomul de siliciu are o proprietate reducătoare în sarcina propusă. Printre produsele de reacție se află azotul (II), unul dintre compușii de pornire este acidul azotic. În mod logic, determinăm că produsul lipsă al reacției este apă. Pasul final va fi dispunerea coeficienților stereochimici rezultanți în reacție.
3Si + 4HNO3 + 18HF = 3H2Sif6 + 4NO + 8 H2O
Un exemplu de problemă privind ecuația
Este necesar să se determine cantitatea de soluție de acid clorhidric 10%, care este de densitate 1,05 g / ml necesară pentru neutralizarea completă a hidroxidului de calciu format în timpul hidrolizei carburii sale. Este cunoscut faptul că gazul emis în timpul hidrolizei, ocupă un volum de 8.96 L (n y ..) Pentru a face față cu sarcina, este necesar mai întâi hidroliza proces de carbură de calciu Echivala:
Cac2 + 2H2O = Ca (OH)2 + C2H2
Hidroxidul de calciu interacționează cu acid clorhidric, se produce neutralizarea completă:
Ca (OH)2 + 2HCI = CaCI2 + 2H2O

Calculați masa de acid care va fi necesară pentru acest proces. Se determină volumul soluției de acid clorhidric gazos. Toate calculele bazate pe sarcină sunt efectuate ținând cont de coeficienții stereochimici, ceea ce confirmă importanța acestora.
În concluzie
Analiza rezultatelor examenului de stat unificat în domeniul chimiei indică faptul că sarcinile asociate producției factorilor stereochimice în ecuațiile unui echilibru electronic, determinarea de oxidanți și agenți reducători cauzând dificultăți serioase pentru moderni absolvenții de gimnaziu. Din păcate, gradul de independență a absolvenților moderne este aproape minimă, astfel încât testarea cadrului teoretic propus de profesor, elevii de liceu nu petrec.
Printre greșelile tipice pe care elevii le permit, plasând coeficienții în reacții de diferite tipuri, există multe erori matematice. De exemplu, nu toată lumea poate găsi numerele cel mai puțin comune, împărțirea corectă și multiplicarea corectă. Motivul acestui fenomen este reducerea numărului de ore alocate școlilor educaționale pentru a studia acest subiect. În cadrul programului de chimie de bază, profesorii nu au posibilitatea de a lucra cu studenții lor în probleme legate de compilarea unui echilibru electronic în procesul de reducere a oxidării.
 Reacția compusului: Exemple și formule
Reacția compusului: Exemple și formule Fundamentele teoretice ale Ingineriei Electrice: Metoda Stresului Nodal
Fundamentele teoretice ale Ingineriei Electrice: Metoda Stresului Nodal Proprietățile și căile de căutare a rădăcinilor ecuației patrate
Proprietățile și căile de căutare a rădăcinilor ecuației patrate Metoda de semireactionare: algoritm
Metoda de semireactionare: algoritm Sisteme de ecuații algebrice liniare. Sisteme omogene de ecuații algebrice liniare
Sisteme de ecuații algebrice liniare. Sisteme omogene de ecuații algebrice liniare Ce este OVR în chimia modernă?
Ce este OVR în chimia modernă? Cum se compune o ecuație chimică: reguli, exemple. Înregistrarea reacției chimice
Cum se compune o ecuație chimică: reguli, exemple. Înregistrarea reacției chimice Care este schema de echilibrare electronică?
Care este schema de echilibrare electronică? Legea echivalentelor
Legea echivalentelor Ecuațiile chimice: cum să rezolve cel mai eficient
Ecuațiile chimice: cum să rezolve cel mai eficient Reacția interacțiunii dintre CaCl2, H2SO4
Reacția interacțiunii dintre CaCl2, H2SO4 Esența reacției chimice. Legea conservării substanțelor în masă (chimie)
Esența reacției chimice. Legea conservării substanțelor în masă (chimie) Exemple de sisteme de ecuații liniare: metoda de rezolvare
Exemple de sisteme de ecuații liniare: metoda de rezolvare Clasificarea reacțiilor chimice
Clasificarea reacțiilor chimice Fenomenele chimice din viața de zi cu zi
Fenomenele chimice din viața de zi cu zi Ecuații liniare cu una și două variabile, inegalități liniare
Ecuații liniare cu una și două variabile, inegalități liniare Exemple de reacții de reducere a oxidării cu soluție. OVR: scheme
Exemple de reacții de reducere a oxidării cu soluție. OVR: scheme Ecuații diferențiale - Informații generale și domeniu de aplicare
Ecuații diferențiale - Informații generale și domeniu de aplicare Ecuația reacției chimice - înregistrarea reacției chimice condiționate
Ecuația reacției chimice - înregistrarea reacției chimice condiționate Rezolvarea ecuatiilor patrate si construirea de grafice
Rezolvarea ecuatiilor patrate si construirea de grafice Rădăcina ecuației este informația de familiarizare
Rădăcina ecuației este informația de familiarizare
 Fundamentele teoretice ale Ingineriei Electrice: Metoda Stresului Nodal
Fundamentele teoretice ale Ingineriei Electrice: Metoda Stresului Nodal Proprietățile și căile de căutare a rădăcinilor ecuației patrate
Proprietățile și căile de căutare a rădăcinilor ecuației patrate Metoda de semireactionare: algoritm
Metoda de semireactionare: algoritm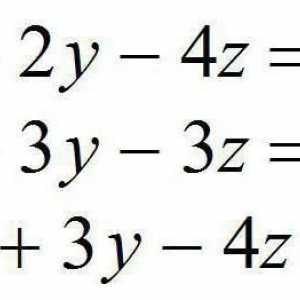 Sisteme de ecuații algebrice liniare. Sisteme omogene de ecuații algebrice liniare
Sisteme de ecuații algebrice liniare. Sisteme omogene de ecuații algebrice liniare Ce este OVR în chimia modernă?
Ce este OVR în chimia modernă? Cum se compune o ecuație chimică: reguli, exemple. Înregistrarea reacției chimice
Cum se compune o ecuație chimică: reguli, exemple. Înregistrarea reacției chimice Care este schema de echilibrare electronică?
Care este schema de echilibrare electronică? Ecuațiile chimice: cum să rezolve cel mai eficient
Ecuațiile chimice: cum să rezolve cel mai eficient Reacția interacțiunii dintre CaCl2, H2SO4
Reacția interacțiunii dintre CaCl2, H2SO4