Ce sunt halogeni? Proprietăți chimice, caracteristici, caracteristici ale producției
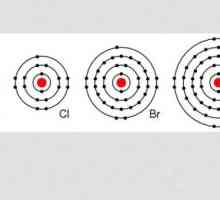
Halogenii sunt nemetalici pronunțați. Acestea includ fluor, astatin, iod, brom, clor, și un element artificial numit ununseptiu (tennessin). Aceste substanțe au o gamă largă de funcții chimice și ar trebui descrise mai detaliat.
conținut

Activitate oxidativă ridicată
Aceasta este prima proprietate clar exprimată care trebuie menționată. Toți halogeni au activitate oxidantă ridicată, dar mai ales fluor. În continuare în jos: clor, brom, iod, astatină, ununseptium. Dar fluorul reacționează cu toate metalele fără excepție. Mai mult, majoritatea, care apar în atmosfera acestui element, se autoinfectează, iar acest proces este însoțit de eliberarea unei cantități mari de căldură.
Dacă fluorul nu este încălzit, atunci în acest caz acesta va reacționa cu multe substanțe nemetalice. De exemplu, cu sulf, carbon, siliciu, fosfor. Reacțiile sunt extrem de exoterme și pot fi însoțite de o explozie.
De asemenea, este de remarcat faptul că fluorul oxidează toți ceilalți halogeni când este încălzit. Schema este următoarea: Hal2 + F2 = 2HalF. Și aici Hal este clor, brom și iod. Și în astfel de compuși, gradul de oxidare a acestora este +1.
Și încă o proprietate chimică a halogenului-fluor este reacția sa cu gaze inerte grele sub influența iradierii. Ele sunt numite și nobile. Astfel de gaze includ heliu, neon, argon, krypton, xenon, radon și recent descoperit Oganeson.

Interacțiunea cu substanțe complexe
Aceasta este încă o altă proprietate chimică a halogenurilor. K substanțe complexe, după cum se știe, sunt compuși constând din două sau mai multe elemente. Același fluor se manifestă în astfel de reacții foarte viguros. Sunt însoțite de o explozie. Și aici, de exemplu, așa ca în formula formulării, reacția cu apă arată: 2F2 + 2H2O → 4HF + O2.
Clorul este, de asemenea, reactiv, deși activitatea sa este mai mică decât cea a fluorului. Dar reacționează cu toate substanțele simple, cu excepția gazelor nobile, a azotului și a oxigenului. Iată un exemplu: Si + 2Cl2 → SiCI4 + 662kJ.
Dar reacția clorului cu hidrogen este deosebit de interesantă. Dacă nu există iluminare și temperatură corespunzătoare, atunci nu se întâmplă nimic între ele. Dar dacă creșteți luminozitatea și încălziți-o, atunci va exista o explozie și mecanismul lanțului. Reacția are loc sub influența fotonilor, quanta radiațiilor electromagnetice, care disociază Cl2 pe atomi. Apare un întreg lanț de reacții, iar în fiecare dintre ele se produce o particulă, care inițiază începutul etapei ulterioare.
brom
Așa cum era deja posibil să observăm, se vorbește mai ales despre fluor și puțin mai puțin despre clor. Toate deoarece proprietățile chimice ale halogenurilor scad în mod constant de la fluor la astatină.
Brom este un fel de mijloc în rândul lor. Este mai bine decât alte halogeni se dizolvă în apă. Soluția rezultată este cunoscută sub numele de apă de brom, o substanță puternică capabilă să oxideze nichelul, fierul, cromul, cobaltul și manganul.
Dacă vorbim despre proprietățile chimice ale halogenului, merită menționat faptul că, prin activitate, ocupă o poziție intermediară între clorul și iodul notorii. Apropo, când reacționează cu soluțiile de iodură, se eliberează iod liber. Se pare ca aceasta: Br2 + 2Kl → I2 + 2KBr.
De asemenea, brom poate reacționa cu nemetalelor (telur și seleniu) și în stare lichidă este reacționat cu aur, formând astfel tribromura AuBr3. De asemenea, este capabil să se alăture moleculelor organice cu o legătură triplă. Dacă este încălzit în prezența unui catalizator, acesta poate reacționa cu benzenul pentru a forma brombenzen C6H5Br, ceea ce se numește substituție.

iod
Următoarele proprietăți chimice cele mai active ale substanțelor halogente din tabel sunt iodul. Particularitatea lui constă în faptul că formează o serie de acizi diferiți. Acestea includ:
- Iodură de hidrogen. Lichid incolor, cu miros înțepător. Acid puternic, care este un puternic agent reducător.
- Yodnovatistaya. Instabil, poate exista numai în soluții foarte diluate.
- Lodura. Caracteristicile sunt aceleași ca cele precedente. Formează săruri cu iod.
- Iodic. O substanță incoloră, cristalină, cu un luciu de sticlă. Solubil în apă, predispus la polimerizare. Are proprietăți de oxidare.
- Iod. Substanță cristalină higroscopică. Se folosește în chimia analitică ca oxidant.
Pentru proprietățile chimice generale ale halogenului-iodului este o activitate ridicată. Deși este mai mică decât cea a clorului cu brom și mai ales nu este comparabilă cu fluorul. Cea mai faimoasă reacție este interacțiunea dintre iod și amidon, ceea ce are ca rezultat o colorare albastră a acestuia din urmă.

astatin
Despre el, de asemenea, este de a spune câteva cuvinte în continuarea discuției despre caracteristicile generale ale halogenurilor. Proprietățile fizice și chimice ale astat sunt apropiate de cele pe care le deține notorii iod și poloniu (element radioactiv). Iată scurta descriere:
- Formează o sare insolubilă a AgAt, ca toate halogeni.
- Poate fi oxidat în starea At, ca și iodul.
- Cu metale, formează compuși care prezintă o stare de oxidare de -1. Ca toate halogeni, deși.
- Reacționează cu iod și brom, formând compuși interhalogeni. Iodură și bromură de astatină, pentru a fi mai precise (AtI și AtBr).
- Se dizolvă în acizi azotați și acid clorhidric.
- Dacă acționați pe aceasta cu hidrogen, se formează hidrat de hidrogen gazos - un acid gazos slab.
- Ca toate halogeni, poate înlocui hidrogenul într-o moleculă de metan.
- Are o radiație alfa caracteristică. Prin prezența sa, se determină prezența astatinei.
Apropo, introducerea astatinei sub forma unei soluții în corpul uman este tratată cu glanda tiroidă. În radioterapie, acest element este utilizat în mod activ.

Tennesin
Și trebuie să acorde atenție, deoarece vorbim de proprietățile chimice ale halogenurilor. Legăturile cu tennesin nu sunt foarte cunoscute, deoarece caracteristicile sale exacte sunt încă subiect de discuție, deoarece acestea au fost incluse în tabel numai în 2014.
Cel mai probabil, este semimetal. Nu are aproape nici o capacitate oxidativă, fiind astfel cel mai slab dintre halogeni, deoarece electronii din nucleu sunt prea departe. Dar există o mare probabilitate ca tennessin să fie acel halogen, a cărui proprietate de reducere va fi superioară celei de oxidare.
Reacția cu hidrogen a fost efectuată experimental. TsH este cea mai simplă conexiune. Rezultatul Tennesinovodorod continuă majoritatea tendințelor pentru halogenurile de hidrogen.
Proprietăți fizice
Acestea ar trebui discutate pe scurt. Deci:
- Fluorul este un gazos otrăvitor, galben deschis, cu un miros înțepător.
- Clorul este un gaz verde deschis. De asemenea, are un miros ascuțit și este mai otrăvitor decât fluorura.
- Bromul este un lichid greu rosu-maroniu. Vaporii ei sunt foarte otrăviți.
- Iodul este un solid gri închis cu un luciu metalic.
- Astat este un solid alb-negru. Se pare că iodul.
Prepararea halogeni
Despre asta - în sfârșit. Proprietățile chimice și producția de halogeni sunt direct legate. Primul cauzează al doilea. Iată câteva modalități de a obține aceste substanțe:
- Prin electroliza topiturilor sau a soluțiilor de halogenuri - compușii lor cu alte elemente sau radicali.
- Folosind interacțiunea dintre sărurile lor solide și acidul sulfuric. Dar aceasta se aplică numai HF și HCl.
- HBr și HI pot fi obținute prin hidroliza halogenurilor de fosfor.
- Oxidarea acizilor halogenați.
- HCIO se obține prin hidroliză în soluții apoase de clor.
- HOBr se formează datorită interacțiunii dintre apă și halogen.
Dar, în general, există mai multe modalități de obținere, acestea sunt doar exemple. La urma urmei, halogenurile sunt utilizate pe scară largă în industrie. Fluorul este utilizat pentru prepararea lubrifianților, clorul este utilizat pentru albire și dezinfecție, în medicină brom angaja și de fabricare a materialelor fotografice, și chiar vorbesc despre iod nu este necesar.
 Halogeni ... Compuși halogeni
Halogeni ... Compuși halogeni Caracteristica sodiului. Formula de sodiu
Caracteristica sodiului. Formula de sodiu Hidroxidul de fosfor este o formulă, proprietăți
Hidroxidul de fosfor este o formulă, proprietăți Proprietăți chimice ale sulfului. Caracterizarea și punctul de fierbere a sulfului
Proprietăți chimice ale sulfului. Caracterizarea și punctul de fierbere a sulfului Gradul minim și maxim de oxidare a bromului. Proprietăți chimice ale bromului
Gradul minim și maxim de oxidare a bromului. Proprietăți chimice ale bromului Proprietățile fizice ale nemetalilor. Caracterizare după poziție în tabelul periodic
Proprietățile fizice ale nemetalilor. Caracterizare după poziție în tabelul periodic Interacțiunea acizilor cu metale. Interacțiunea acidului sulfuric cu metalele
Interacțiunea acizilor cu metale. Interacțiunea acidului sulfuric cu metalele Halogeni: proprietăți fizice, proprietăți chimice. Utilizarea halogenurilor și a compușilor lor
Halogeni: proprietăți fizice, proprietăți chimice. Utilizarea halogenurilor și a compușilor lor Metode de producere a alchenelor: laborator și industrial
Metode de producere a alchenelor: laborator și industrial Ce sunt halogeni? Elemente chimice de fluor, clor, iod și astatum
Ce sunt halogeni? Elemente chimice de fluor, clor, iod și astatum Elementul chimic fluor: valență, proprietăți, caracteristici
Elementul chimic fluor: valență, proprietăți, caracteristici Fluorul este ceea ce? Proprietățile de fluor
Fluorul este ceea ce? Proprietățile de fluor Non-metalele sunt ...? Proprietăți ale metalelor
Non-metalele sunt ...? Proprietăți ale metalelor Chimie anorganică. Chimie generală și anorganică
Chimie anorganică. Chimie generală și anorganică Proprietățile fizice ale halogenurilor. Semnificația, structura, utilizarea halogeni
Proprietățile fizice ale halogenurilor. Semnificația, structura, utilizarea halogeni Fenolate de sodiu: preparat, proprietăți chimice
Fenolate de sodiu: preparat, proprietăți chimice Acid oxizi: o scurtă descriere a grupului
Acid oxizi: o scurtă descriere a grupului Oxigenul prezintă o stare de oxidare pozitivă în legătură cu ce?
Oxigenul prezintă o stare de oxidare pozitivă în legătură cu ce? Substanțe anorganice: exemple și proprietăți
Substanțe anorganice: exemple și proprietăți Acidele oxizi includ oxizi nemetalici: exemple, proprietăți
Acidele oxizi includ oxizi nemetalici: exemple, proprietăți Proprietăți chimice ale hidrogenului. Importanța hidrogenului în natură
Proprietăți chimice ale hidrogenului. Importanța hidrogenului în natură

 Caracteristica sodiului. Formula de sodiu
Caracteristica sodiului. Formula de sodiu Hidroxidul de fosfor este o formulă, proprietăți
Hidroxidul de fosfor este o formulă, proprietăți Proprietăți chimice ale sulfului. Caracterizarea și punctul de fierbere a sulfului
Proprietăți chimice ale sulfului. Caracterizarea și punctul de fierbere a sulfului Gradul minim și maxim de oxidare a bromului. Proprietăți chimice ale bromului
Gradul minim și maxim de oxidare a bromului. Proprietăți chimice ale bromului Proprietățile fizice ale nemetalilor. Caracterizare după poziție în tabelul periodic
Proprietățile fizice ale nemetalilor. Caracterizare după poziție în tabelul periodic Interacțiunea acizilor cu metale. Interacțiunea acidului sulfuric cu metalele
Interacțiunea acizilor cu metale. Interacțiunea acidului sulfuric cu metalele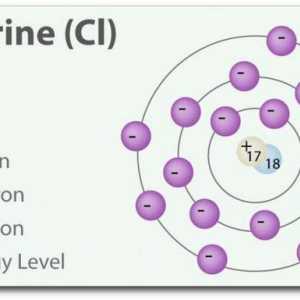 Halogeni: proprietăți fizice, proprietăți chimice. Utilizarea halogenurilor și a compușilor lor
Halogeni: proprietăți fizice, proprietăți chimice. Utilizarea halogenurilor și a compușilor lor Metode de producere a alchenelor: laborator și industrial
Metode de producere a alchenelor: laborator și industrial Ce sunt halogeni? Elemente chimice de fluor, clor, iod și astatum
Ce sunt halogeni? Elemente chimice de fluor, clor, iod și astatum Elementul chimic fluor: valență, proprietăți, caracteristici
Elementul chimic fluor: valență, proprietăți, caracteristici