Spațiu cristalin de gheață și apă
Starea tridimensională a apei lichide este dificil de investigat, dar multe au fost studiate prin analizarea structurii cristalelor de gheață. Patru atomi de oxigen învecinați cu interacțiune cu hidrogen ocupă vârful tetraedrului (tetra = patru, hidron = plan). Energia medie necesară pentru distrugerea unei astfel de legături în gheață este estimată la 23 kJ / mol-1
conținut
- Caracteristicile aspectului gheții (ih)
- Descrierea detaliată a structurilor
- Spațiu cristalin de gheață uscată
- Descrierea laturilor și a elementelor acestora
- Schimbarea substanțelor
- Caracteristici ale dezvoltării
- Ce tip de latură de cristal este caracteristic gheții
- Alte elemente și laturi
- Entropia punctului zero
- Oamenii de știință și lucrările lor în acest domeniu

Capacitatea moleculelor de apă de a forma un anumit număr de lanțuri de hidrogen și, de asemenea, această forță creează un punct de topire neobișnuit de ridicat. Când se topește, este reținută de apă lichidă, a cărei structură este neregulată. Majoritatea legăturilor de hidrogen sunt distorsionate. Pentru a distruge cristalul de gheață cu o legătură de hidrogen necesită o masă mare de energie sub formă de căldură.
Caracteristicile aspectului gheții (Ih)
Mulți dintre orășeni se întreabă de zăpada cristalină de gheață. Trebuie remarcat faptul că densitatea majorității substanțelor crește cu îngheț, când mișcările moleculare încetinesc și se formează cristale dens ambalate. Densitatea de apă crește, de asemenea, atunci când se răcește până la un maxim la 4 ° C (277K). Atunci când temperatura scade sub această valoare, se extinde.
Această creștere se datorează formării de lipit-hidrogen deschis gheață rețea cristalină și cu densitatea mai mică, în care fiecare moleculă de apă este conectat rigid la elementul de mai sus, iar celelalte patru valori, și astfel se mișcă suficient de repede pentru a poseda masa mai mare. De când se întâmplă acest lucru, lichidul îngheață de sus în jos. Acest lucru are rezultate biologice importante, ca urmare a care un strat de gheață pe iaz izolate ființe vii departe de frig extrem. În plus, două proprietăți suplimentare de apă asociate cu caracteristicile sale de hidrogen: specific evaporare teploemkostyui.
Descrierea detaliată a structurilor
Primul criteriu este cantitatea necesară pentru creșterea temperaturii de 1 gram substanță cu 1 ° C. Pentru a crește gradele de apă, este necesară o proporție relativ mare de căldură, deoarece fiecare moleculă participă la numeroase legături de hidrogen, care trebuie distruse astfel încât energia cinetică să crească. Apropo, abundența lui H2O în celulele și țesuturile tuturor organismelor multicelulare mari înseamnă că fluctuația de temperatură din interiorul celulelor este minimizată. Această caracteristică este crucială, deoarece viteza majorității reacțiilor biochimice este sensibilă.
Căldura de evaporare a apei este, de asemenea, semnificativ mai mare decât în multe alte lichide. Pentru a transforma acest corp în gaz, este necesară o cantitate mare de căldură, deoarece legăturile de hidrogen trebuie să fie distruse, astfel încât moleculele de apă să poată fi dispuse una de alta și să intre în faza indicată. Corpurile modificabile sunt dipoli permanenți și pot interacționa cu alți compuși similari și cu aceia care ionizează și se dizolvă.
Alte substanțe menționate mai sus pot intra în contact numai în prezența polarității. Această relație participă la structura acestor elemente. În plus, acesta poate fi aliniat în jurul acestor particule formate din electroliți, astfel încât atomii negativi de oxigen ai moleculelor de apă sunt orientați spre cationi, iar ionii pozitivi și atomii de hidrogen sunt orientați către anioni.
În solide Ca regulă, se formează laturile cu cristale moleculare și laturile atomice. Adică dacă iodul este construit în așa fel încât să conțină I2 apoi în dioxid de carbon solid, adică în gheața uscată, siturile de zăbrele conțin molecule de CO2. Când interacționează cu substanțe similare, rețeaua cristalină ionică are gheață. Grafitul, de exemplu, având o structură atomică pe bază de carbon, nu este capabil să-l schimbe, la fel ca un diamant.
Ce se întâmplă când cristalul de sare de masă se dizolvă în apă: moleculele polare sunt atrase de elementele încărcate în cristal, rezultând formarea de astfel de particule, și clorură de sodiu pe suprafața sa, ca urmare a acestor organisme sunt dislocați unul față de celălalt, și începe să se dizolve. De aici se poate observa că gheața are o latură de cristal cu o legătură ionică. Fiecare dizolvat Na + atrage capetele negative ale mai multor molecule de apă, în timp ce fiecare CI dizolvat - atrage capetele pozitive. Plicul care înconjoară fiecare ion, numită sferă de salvare și de obicei cuprinde mai multe straturi de particule de solvent.

Spațiu cristalin de gheață uscată
Se spune că variabilele sau ionul înconjurat de elemente sunt sulfatate. Când solventul este apă, astfel de particule sunt hidratate. Astfel, orice moleculă polară tinde să fie solvată de elementele unui corp lichid. În gheața uscată, tipul de latură cristalină formează legături atomice în stare agregată, care sunt neschimbate. Un alt lucru este gheața cristalină (apă înghețată). Compușii organici ionici, cum ar fi carboxilazele și aminele protonate, trebuie să aibă o solubilitate în grupările hidroxil și carbonil. Particulele conținute în astfel de structuri se mișcă între molecule, iar sistemele lor polare formează legături de hidrogen cu acest corp.
Desigur, numărul ultimelor grupuri menționate într-o moleculă afectează solubilitatea sa, care depinde și de reacția diferitelor structuri în elementul: de exemplu, unul, doi și trei alcooli carbon miscibil cu apa, dar hidrocarburile mai mari cu compuși cu un singur hidroxil în mult mai puțin diluabilitate lichid.
Ih hexagonal are o formă similară cu cea a cristalului atomic. La gheață și la toată zăpada naturală de pe Pământ, arată așa. Acest lucru este evidențiat prin simetria zăpezii cristaline de gheață, care este produsă din vapori de apă (adică fulgi de zăpadă). Situat în grupul de spațiu P 63 / mm de la 194-D 6h, clasa Laue 6 / mm-similară beta - care are o axă multiplă cu 6 șuruburi (rotație în jurul unei deplasări de-a lungul acesteia). Are o structură destul de deschisă, cu o densitate scăzută, unde eficiența este scăzută (~ 1/3) în comparație cu structurile cubice simple (~ 1/2) sau centrale cubice (~ 3/4).
Comparativ cu gheața convențională, rețeaua cristalină a gheții uscate legată de moleculele de CO2, este statică și se schimbă numai atunci când atomii se descompun.

Descrierea laturilor și a elementelor acestora
Cristalele pot fi considerate ca modele de cristal format din foi dispuse una deasupra celeilalte. Legătura de hidrogen este comandat, în timp ce în realitate este întâmplătoare deoarece protonii se pot deplasa între moleculele de apă (gheață), la temperaturi mai mari de circa 5 K. Într-adevăr, este posibil ca protonii să se comporte ca lichid cuantic în flux constant tunelat. Această împrăștiere îmbunătățită a neutronilor care arată densitatea de împrăștiere la jumătatea distanței dintre atomii de oxigen, ceea ce indică localizarea și mișcarea coordonată. Aici se observă similitudinea gheții cu o latură atomică, cu cristale moleculare.
Moleculele au un aranjament treptat al lanțului de hidrogen cu privire la cei trei vecini din plan. Al patrulea element are o locație eclipsată a legăturii de hidrogen. Există o ușoară abatere de la simetria hexagonală ideală, deoarece celula unității este cu 0,3% mai scurtă în direcția acestui lanț. Toate moleculele suferă aceleași medii moleculare. În fiecare "cutie" există suficient spațiu pentru păstrarea particulelor de apă interstițială. Deși acest lucru nu este în general luat în considerare, acestea au fost recent detectate efectiv prin difracția neutronilor cu o rețea de gheață de cristal pulbere.
Schimbarea substanțelor
corp Hexagonal are un punct triplu cu apă în stare lichidă și gazoasă de 0,01 ° C, 612 Pa, elemente solide - trei -21.985 ° C, 209.9 MPa și Unsprezece două -199,8 ° C, 70 MPa și -34 , 7 ° C, 212,9 MPa. Condiția dielectrică a gheții hexagonale este de 97,5.
Curba de topire a acestui element este dată de MPa. Sunt disponibile ecuații de stare, cu excepția unor inegalități simple care leagă schimbarea proprietăților fizice cu temperatura gheții hexagonale și a suspensiilor sale apoase. Duritatea variază în funcție de gradele care cresc aproximativ de la sau sub gips (le-2) la 0 ° C, până la nivelul de feldspat (6 by scara lui Mohs) la -80 ° C, o schimbare anormal de mare în duritatea absolută (> 24 de ori).
Câmpul de cristal hexagonal din gheață formează plăci și coloane hexagonale, unde fețele superioare și inferioare sunt planuri bazale {0 0 0 1} cu entalpie de 5,57 μJ middot- cm -2, iar celelalte laterale echivalente sunt numite părți ale prismei {1 0 -1 0} cu 5,94 μJ middot- cm -2. Suprafețele secundare {1 1 -2 0} de la 6.90 mu-J ˣ cm -2 pot fi formate pe planurile formate de laturile structurilor.
O structură similară arată o scădere anormală a conductivității termice cu presiune crescătoare (cum ar fi gheața cubică și amorfă de densitate scăzută), dar diferă de cele mai multe cristale. Aceasta se datorează unei modificări a legăturii de hidrogen, care reduce viteza transversală a sunetului în rețeaua cristalină a gheții și a apei.
Există metode care descriu modul de preparare a probei mare de cristal și orice suprafață dorită a gheții. Se presupune că legătura de hidrogen la suprafața corpului hexagonal al testului va fi mai simplificat decât volumul din interiorul sistemului. Variația spectroscopie generarea frecvenței de oscilație cu faza grilaj demonstrat că există o asimetrie structurală între cele două straturi superioare (L1 și L2), în subteran HO suprafața bazală a lanțului de gheață hexagonale. legături de hidrogen acceptate în straturile superioare ale hexagoane (L1 O middot-middot-middot-HO L2) este mai puternic decât cele luate în al doilea strat la acumularea superioară (L1 OH middot-middot-middot-O L2). Sunt disponibile structuri interactive de gheață hexagonală.

Caracteristici ale dezvoltării
Numărul minim de molecule de apă necesare pentru nuclearea gheții este de aproximativ 275 ± 25, ca pentru un cluster complet icosaedic 280. Formarea are loc cu un coeficient de 10 10 pe interfața aer-apă și nu în apă vrac. Creșterea cristalelor de gheață depinde de diferitele rate de creștere ale diferitelor energii. Apa trebuie protejată împotriva înghețării atunci când se prepară specimene biologice, alimente și organisme biologice.
De obicei, acest lucru se realizează prin rate rapide de răcire, prin utilizarea probelor mici și crio-conservatoare și prin creșterea presiunii pentru a forma embrioni de gheață și prevenirea deteriorării celulelor. Energia liberă a gheții / lichidului crește de la ~ 30 mJ / m2 la presiune atmosferică de până la 40 mJ / m-2 la 200 MPa, care indică motivul efectului similar.
Ce tip de latură de cristal este caracteristic gheții
Alternativ, ele pot crește mai repede de pe suprafețele prismei (S2), pe suprafața accidentală perturbată a lacurilor congelate sau agitate. Creșterea de la fețe {1 1 -2 0} este cel puțin aceeași, dar le transformă în bazele prismei. Datele privind dezvoltarea cristalelor de gheață au fost complet investigate. Ratele de creștere relativă a elementelor de diferite fețe depind de capacitatea de a forma un grad mai mare de hidratare articulară. Temperatura (scăzută) a apei din jur determină gradul de ramificare în cristalul de gheață. Creșterea particulelor este limitată de rata de difuzie la un grad scăzut de supracoolizare, adică, <2 ° C, ceea ce duce la mai multe dintre ele.

Dar este limitat de cinetica dezvoltării la niveluri mai ridicate de scădere a gradei> 4 ° C, ceea ce duce la creșterea acului. Această formă este similară cu structura de gheata uscata (cu o structură de rețea cristalină hexagonală), diferite caracteristici ale suprafeței și a apei temperatura mediului ambiant (subrăcit), care se află în spatele formelor plane fulgi de zăpadă.
Nuclearea gheții din atmosferă afectează profund formarea și proprietățile nori. Feldspar, găsit în praf deșert, care intră în atmosferă cu milioane de tone pe an, sunt educatori importanți. Modelarea computerelor a arătat că acest lucru se datorează nucleării planurilor de cristale de gheață prismatice pe planurile suprafeței de înaltă energie.
Alte elemente și laturi
Substanțele dizolvate (cu excepția heliu și hidrogen foarte mici, care pot fi încorporate în interstiții) nu pot fi incluse în structura Ih la presiunea atmosferică, dar deplasată pe suprafața unui strat amorf sau microcristalina între particulele corpului. La nodurile laturii cristaline a gheții uscate există și alte elemente: ioni haotropici, cum ar fi NH4 + și Cl -, care sunt incluse într-o înghețare mai ușoară a fluidelor decât alte kosmotropice, cum ar fi Na + și SO42-, astfel încât acestea nu pot fi îndepărtate, deoarece formează o peliculă subțire a lichidului rămas între cristale. Acest lucru poate duce la suprafața de încărcare electrică datorită disocierii taxelor de contrabalansare a apelor de suprafață rămase (ceea ce poate duce, de asemenea, la radiația magnetică) și o modificare a pH-ului filmelor lichide reziduale, de exemplu, NH 42SO4 devine mai acid și NaCl devine mai alcalin.
Ele sunt perpendiculare pe fețele grilajului de gheață care arată stratul următor atașat (cu atomi negri O). Se caracterizează printr-o suprafață bazală cu creștere lentă {0 0 0 1}, unde sunt atașate numai molecule de apă izolate. Suprafața cu creștere rapidă (1 0 -1 0 0) a prismei, unde perechi de particule noi atașate pot comunica unul cu celălalt prin hidrogen (unul dintre legăturile sale / două molecule ale elementului). Fața cu cea mai rapidă creștere {1 1 -2 0} (prisma secundară), unde lanțurile de particule noi atașate pot interacționa una cu cealaltă printr-o legătură hidrogen. Unul dintre lanțurile sale / moleculă a elementului este forma care formează crestături, care împart și încurajează transformarea în două laturi a prismei.

Entropia punctului zero
Poate fi definit ca S 0 = k B ˣ Ln (N E0), unde k B este constanta Boltzmann, NENumărul de configurații la o energie E, iar E0 este cea mai mică energie. Această valoare pentru entropia de gheață hexagonale la zero grade Kelvin nu încalcă legea a treia a termodinamicii „entropie cristal perfectă la zero absolut exact zero“, deoarece aceste elemente nu sunt ideale, iar particulele sunt dezordonate legături de hidrogen.
În acest corp, legătura de hidrogen este aleator și se schimbă rapid. Aceste structuri nu sunt la fel de egale în ceea ce privește energia, ci se extind la un număr foarte mare de state strânse din punct de vedere energetic, respectă "regulile de gheață". Entropia punctului zero este o mizerie care ar rămâne, chiar dacă materialul ar putea fi răcit la zero absolută (0 K = -273,15 ° C). Dă naștere unei confuzii experimentale pentru gheața hexagonală 3,41 (± 0,2) ˣ mol -1 ˣ K -1. Teoretic, se poate calcula entropia zero, cristalele de gheață celebre cu (defecte, neglijând și răspândirea nivelurilor de energie) precizie mult mai mare decât să-l determine experimental.
Oamenii de știință și lucrările lor în acest domeniu
Poate fi definit ca S 0 = k B ˣ Ln (N E0), unde k B este constanta Boltzmann, NENumărul de configurații la o energie E, iar E0 este cea mai mică energie. Această valoare pentru entropia de gheață hexagonale la zero grade Kelvin nu încalcă legea a treia a termodinamicii „entropie cristal perfectă la zero absolut exact zero“, deoarece aceste elemente nu sunt ideale, iar particulele sunt dezordonate legături de hidrogen.
În acest corp, legătura de hidrogen este aleator și se schimbă rapid. Aceste structuri nu sunt la fel de egale în ceea ce privește energia, ci se extind la un număr foarte mare de state strânse din punct de vedere energetic, respectă "regulile de gheață". Entropia punctului zero este o mizerie care ar rămâne, chiar dacă materialul ar putea fi răcit la zero absolută (0 K = -273,15 ° C). Dă naștere unei confuzii experimentale pentru gheața hexagonală 3,41 (± 0,2) ˣ mol -1 ˣ K -1. Teoretic, se poate calcula entropia zero, cristalele de gheață celebre cu (defecte, neglijând și răspândirea nivelurilor de energie) precizie mult mai mare decât să-l determine experimental.

Deși ordinea protonilor în cea mai mare parte de gheață nu este comandat, suprafața este, probabil, procedeu de preferat particulele menționate în formă de agățat benzi H și atomi de O, perechile individuale (entropie zero cu legături de hidrogen comandate). Zero tulburare punct ZPE, J ˣ mol -1 ˣ K -1 și altele. Din toate cele de mai sus este clar și clar ce tipuri de laturi de cristal sunt caracteristice gheții.
 Ce constă în apă: din care molecule și atomi
Ce constă în apă: din care molecule și atomi Proprietăți fizice și chimice unice ale apei
Proprietăți fizice și chimice unice ale apei Proprietățile fizice ale aldehidelor
Proprietățile fizice ale aldehidelor Ledostav este o perioadă specială în natură
Ledostav este o perioadă specială în natură Gheața toros. Care este acest fenomen?
Gheața toros. Care este acest fenomen? Structura spațială a moleculelor de substanțe anorganice și organice
Structura spațială a moleculelor de substanțe anorganice și organice Cum se determină compoziția calitativă și cantitativă a materiei
Cum se determină compoziția calitativă și cantitativă a materiei Pe care atomi este molecula de apă împărțită? Formula, reacțiile chimice
Pe care atomi este molecula de apă împărțită? Formula, reacțiile chimice Cum are loc trecerea unei substanțe dintr-o stare lichidă într-o stare solidă?
Cum are loc trecerea unei substanțe dintr-o stare lichidă într-o stare solidă? Tipuri de laturi cristaline de diferite substanțe
Tipuri de laturi cristaline de diferite substanțe Starea agregată a materiei
Starea agregată a materiei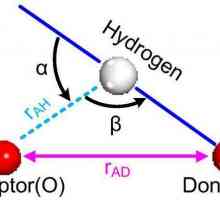 Legătura cu hidrogen: exemple și tipuri de legături chimice
Legătura cu hidrogen: exemple și tipuri de legături chimice Nivelurile organizării structurale a moleculei de proteine: structura secundară a proteinei
Nivelurile organizării structurale a moleculei de proteine: structura secundară a proteinei Substanțe simple
Substanțe simple Ne amintim fizica - care este capacitatea de căldură a apei?
Ne amintim fizica - care este capacitatea de căldură a apei? Ce este o legătură de hidrogen? Tipuri, influență
Ce este o legătură de hidrogen? Tipuri, influență Cristal ionic
Cristal ionic Energia de ionizare a unui atom
Energia de ionizare a unui atom De ce gheața nu se scufunda în apă: răspunsurile
De ce gheața nu se scufunda în apă: răspunsurile Proprietățile gheții: structura, proprietățile mecanice și fizice ale gheții
Proprietățile gheții: structura, proprietățile mecanice și fizice ale gheții Legătura covalentă nepolară este o legătură chimică formată din atomi identici
Legătura covalentă nepolară este o legătură chimică formată din atomi identici
 Ledostav este o perioadă specială în natură
Ledostav este o perioadă specială în natură Gheața toros. Care este acest fenomen?
Gheața toros. Care este acest fenomen? Structura spațială a moleculelor de substanțe anorganice și organice
Structura spațială a moleculelor de substanțe anorganice și organice Cum se determină compoziția calitativă și cantitativă a materiei
Cum se determină compoziția calitativă și cantitativă a materiei Pe care atomi este molecula de apă împărțită? Formula, reacțiile chimice
Pe care atomi este molecula de apă împărțită? Formula, reacțiile chimice Cum are loc trecerea unei substanțe dintr-o stare lichidă într-o stare solidă?
Cum are loc trecerea unei substanțe dintr-o stare lichidă într-o stare solidă?