Prima și a doua lege a lui Faraday
Electrolitul are întotdeauna un anumit număr de ioni cu semne plus și minus, care rezultă din interacțiunea moleculelor substanței dizolvate cu solventul. Când apare un câmp electric, ionii încep să se deplaseze către electrozii, cei pozitivi se îndreaptă către catod, cei negativi către anod. După ce au ajuns la electrozi, ionii le-au dat sarcina, s-au transformat în atomi neutri și s-au depus pe electrozi. Cât mai mulți ioni se apropie de electrozii, cu atât mai mult vor fi depuși pe ele.
Putem ajunge la această concluzie prin experiență. Să trecem curentul printr-o soluție apoasă sulfat de cupru și vom observa eliberarea de cupru pe catodul de carbon. Observăm că la început va fi acoperit cu un strat de cupru abia vizibil, atunci când curentul va trece, va crește și dacă curentul va fi transmis pentru o lungă perioadă de timp, carbon electrod o grosime considerabilă a unui strat de cupru, la care este ușor de lipit, de exemplu, un fir de cupru.
Fenomenul eliberării materiei pe electrozii în timpul trecerii curentului prin electrolit se numește electroliză.
Trecerea prin diferite curenți de electroliză și măsurarea cu atenție a masei de materie eliberată pe electrozi de la fiecare electrolit, engleza fizicianul Faraday în 1833 - 1834 de ani. au descoperit două legi pentru electroliză.
Prima lege a lui Faraday stabilește relația dintre masa materiei eliberate în timpul electrolizei și cantitatea de încărcare care a trecut prin electrolit.
Această lege este formulată după cum urmează: masa materiei care a fost eliberată în timpul electrolizei pe fiecare electrod este direct proporțională cu mărimea încărcăturii care a trecut prin electrolit:
m = kq,
unde m este masa substanței care a fost eliberată, q este încărcătura.
Cantitatea k este echivalentul electrochimic al substanței. Este caracteristic pentru fiecare substanță eliberată în timpul electrolitic.
Dacă formula ia q = 1 ca o coulombă, atunci k = m, adică echivalentul electrochimic al substanței va fi numeric egal cu masa substanței separate de electrolit la trecerea încărcăturii într-un singur pendant.
Exprimând în formula sarcina prin curentul I și timpul t, primim:
m = kIt.
Prima lege Faraday este verificată experimental după cum urmează. Trecerea unui curent prin electroliții A, B și C. Dacă acestea sunt identice, atunci masa substanței selectate în A, B și C vor fi tratate ca curenții I, I1, I2. Numărul de substanțe selectate în A, este egal cu suma volumelor alocate B și C, deoarece curentul I = I1 + I2.
A doua lege a lui Faraday stabilește dependența echivalentului electrochimică a greutății și valență substanță atomică și formulată după cum urmează: echivalent electrochimic al substanței va fi proporțională cu greutatea lor atomică, și invers proporțională cu valența.
Raportul dintre greutatea atomică a unei substanțe și valența sa se numește echivalentul chimic al unei substanțe. După introducerea acestei valori, a doua lege a lui Faraday poate fi formulată în mod diferit: echivalentele electrochimice ale substanței sunt proporționale cu propriile lor echivalente chimice.
Fie ca echivalentele electrochimice ale diferitelor substanțe să fie egale cu k1 și k2, k3, hellip-, kn, echivalenți chimici ai acelorași substanțe x1 și x2, x23, atunci k1 / k2 = x1 / x2 sau k1 / x1 = k2 / x2 = k3 / x3 = hellip- = kn / xn.
Cu alte cuvinte, raportul dintre mărimea echivalentului electrochimic al unei substanțe și valoarea aceleiași substanțe este o valoare constantă, având pentru toate substanțele aceeași valoare:
k / x = c.
Rezultă că raportul k / x este constant pentru toate substanțele:
k / x = c = 0, 01036 (mg-eq) / k.
Valoarea lui c arată cât de multe echivalente de miligrame ale substanței sunt eliberate pe electrozii în timpul trecerii prin electrolit încărcătura electrică, este egal cu 1 coulomb. A doua lege a lui Faraday este reprezentată de formula:
k = cx.
Înlocuind expresia rezultată pentru k în prima lege a lui Faraday, ambele pot fi combinate într-o singură expresie:
m = kq = cxq = cxIt,
unde c este constanta universala, egala cu 0, 00001036 (g-eqv) / k.
Această formulă arată că prin trecerea același curent pentru aceeași perioadă de timp, în două electrolit diferite, am separa atât cantitatea de substanțe electroliti aparținând echivalentele chimice ale acestora.
Deoarece x = A / n, putem scrie:
m = cA / nIt,
adică masa materiei eliberată pe electrozi în timpul electrolizei va fi direct proporțională cu cea a acesteia greutate atomică, curent, timp și invers proporțional cu valența.
A doua lege a lui Faraday pentru electroliză, la fel ca prima, rezultă direct din caracterul ionic al curentului din soluție.
Legea lui Faraday, Lenz și a multor altor fizicieni remarcabili au jucat un rol imens în istoria formării și dezvoltării fizicii.
 Cum să faci singur efectul Biefeld-Brown?
Cum să faci singur efectul Biefeld-Brown? Disocierea sărurilor, acizilor și alcalinilor. Teoria și aplicarea practică
Disocierea sărurilor, acizilor și alcalinilor. Teoria și aplicarea practică Ioni sunt atomi care poartă sarcină
Ioni sunt atomi care poartă sarcină Catodul și anodul - unitatea și lupta contrarelor
Catodul și anodul - unitatea și lupta contrarelor Proprietăți ale electroliților. Electroliți puternici și slabi. Electroliți - ce este?
Proprietăți ale electroliților. Electroliți puternici și slabi. Electroliți - ce este? Rezistența internă a sursei de curent. Rezistența este formula
Rezistența internă a sursei de curent. Rezistența este formula Lămpi controlate electronic: diode și triode
Lămpi controlate electronic: diode și triode Electroliza soluțiilor: descriere, aplicare
Electroliza soluțiilor: descriere, aplicare Ce este electroliza? Anod și catod. Procesul fizico-chimic
Ce este electroliza? Anod și catod. Procesul fizico-chimic Anod și catod - ce este și cum să o determinăm corect?
Anod și catod - ce este și cum să o determinăm corect? Element galvanic: schemă, principiu de funcționare, aplicare
Element galvanic: schemă, principiu de funcționare, aplicare Cea mai largă aplicare a electrolizei
Cea mai largă aplicare a electrolizei Elemente galvanice: principiul acțiunii și soiurilor
Elemente galvanice: principiul acțiunii și soiurilor Electroliza apei. Cum are loc procesul și de ce este nevoie
Electroliza apei. Cum are loc procesul și de ce este nevoie Curent electric în gaze
Curent electric în gaze Legea Joule-Lenz
Legea Joule-Lenz Curent, curent electric în vid
Curent, curent electric în vid Curentul electric în lichide: originea sa, caracteristicile cantitative și calitative
Curentul electric în lichide: originea sa, caracteristicile cantitative și calitative Curent electric în diverse medii
Curent electric în diverse medii Descărcarea coroanei: caracteristicile și proprietățile de bază
Descărcarea coroanei: caracteristicile și proprietățile de bază Sudarea manuală: caracteristici și clasificare
Sudarea manuală: caracteristici și clasificare
 Ioni sunt atomi care poartă sarcină
Ioni sunt atomi care poartă sarcină Catodul și anodul - unitatea și lupta contrarelor
Catodul și anodul - unitatea și lupta contrarelor Proprietăți ale electroliților. Electroliți puternici și slabi. Electroliți - ce este?
Proprietăți ale electroliților. Electroliți puternici și slabi. Electroliți - ce este? Rezistența internă a sursei de curent. Rezistența este formula
Rezistența internă a sursei de curent. Rezistența este formula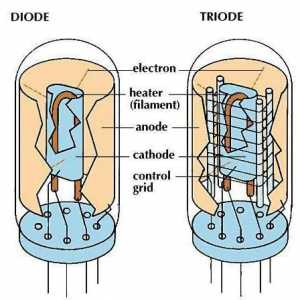 Lămpi controlate electronic: diode și triode
Lămpi controlate electronic: diode și triode Ce este electroliza? Anod și catod. Procesul fizico-chimic
Ce este electroliza? Anod și catod. Procesul fizico-chimic Anod și catod - ce este și cum să o determinăm corect?
Anod și catod - ce este și cum să o determinăm corect? Element galvanic: schemă, principiu de funcționare, aplicare
Element galvanic: schemă, principiu de funcționare, aplicare