Factorii care determină solubilitatea proteinelor. Proprietățile fizico-chimice ale proteinelor
Articolul nostru va fi dedicat studiului proprietăților substanțelor care stau la baza fenomenului vieții pe Pământ. Moleculele de proteine sunt prezente în forme non-celulare - viruși, fac parte din citoplasmă și organoide ale celulelor procariote și nucleare. Împreună cu acizii nucleici, ele formează o substanță de ereditate - cromatină și formează componentele principale ale nucleului - cromozomul. Semnalul, construcția, energia catalitică, de protecție, este o listă a funcțiilor biologice pe care le îndeplinesc proteinele. Proprietățile fizico-chimice ale proteinelor sunt capacitatea lor de a se dizolva, precipita, sare. În plus, ele sunt capabile să denatureze și sunt prin compuși chimici compuși amfoterici. Să studiem în continuare aceste proprietăți ale proteinelor.
conținut
- Tipuri de monomeri proteici
- Ce factori afectează solubilitatea peptidelor?
- Globule și capacitatea lor de hidratare
- Fibrilă peptide
- Keratin și caracteristicile structurii lor
- Efectul ph-ului mediului asupra sarcinii polimerului proteic
- Factorii care determină solubilitatea proteinelor
- Comportamentul proteinelor într-un câmp electric
- Cum afectează solubilitatea proteinei concentrația de săruri
- Salting out
- Precipitarea și denaturarea

Tipuri de monomeri proteici
20 de specii alfa-aminoacizii sunt unitățile structurale ale proteinei. În plus față de radicalul hidrocarbonat, conțin NH2- o grupare amino și o grupare COOH-carboxil. Grupurile funcționale determină proprietățile acide și bazice monomerii proteinei. Prin urmare, în chimia organică, compușii din această clasă se numesc substanțe amfoterice. Ionii de hidrogen ai grupării carboxil din moleculă pot fi scindați și legați la grupe amino. Ca rezultat, se formează sarea interioară. Dacă mai multe grupări carboxil sunt prezente în moleculă, compusul va fi acid, cum ar fi acidul glutamic sau acidul aspartic. Dacă grupurile amino predomină, aminoacizii sunt bazici (histidină, lizină, arginină). Cu un număr egal de grupări funcționale, soluția de peptidă are o reacție neutră. Se constată că prezența celor trei tipuri de aminoacizi influențează ce semne vor avea proteine. Proprietățile fizico-chimice ale proteinelor: solubilitatea, indicele de hidrogen, încărcarea unei macromolecule, sunt determinate de raportul aminoacizilor acizi și bazici.
Ce factori afectează solubilitatea peptidelor?
Vom clarifica toate criteriile necesare pe care depind procesele de hidratare sau solvatare a macromoleculelor de proteine. Acestea sunt: configurația spațială și greutatea moleculară, determinată de numărul de resturi de aminoacizi. De asemenea, se ia în considerare raportul dintre părțile polar și nepolar - radicalii localizați pe suprafața proteinei din structura terțiară și sarcina totală a macromoleculei polipeptidice. Toate proprietățile de mai sus afectează direct solubilitatea proteinei. Să le analizăm mai detaliat.

Globule și capacitatea lor de hidratare
Dacă structura externă a peptidei este sferică, atunci este obișnuit să vorbim despre structura sa globulară. Este stabilizat de legăturile hidrogen și hidrofob, precum și de forțele de atracție electrostatică a unor părți încărcate eterogene ale macromoleculei. De exemplu, hemoglobina, care transportă molecula de oxigen prin sânge, în forma cuaternară constă din patru fragmente de mioglobină combinate cu hemă. Astfel de proteine din sânge, ca albumine, alfa- și upsih-globuline, interacționează cu ușurință cu substanțele din plasma sanguină. Insulina este o altă peptidă globulară care reglează nivelul de glucoză din sângele mamiferelor și al oamenilor. Componentele hidrofobe ale unor astfel de complexe peptidice se află în mijlocul unei structuri compacte, iar părțile hidrofile sunt localizate pe suprafața sa. Aceasta asigură păstrarea proprietăților lor native în mediul lichid al organismului și le unește într-un grup de proteine solubile în apă. Excepție sunt proteinele globulare care formează structura mozaică a membranelor celulelor umane și animale. Acestea sunt legate de glicolipide și insolubile în fluidul intercelular, ceea ce asigură că aceștia îndeplinesc un rol de barieră în celulă.
Fibrilă peptide
Colagenul și elastina, care fac parte din dermă și cauzează elasticitatea și elasticitatea acesteia, au o structură cu fir. Ele sunt capabile să se întindă, schimbând configurația lor spațială. Fibroina este o proteină din mătase naturală produsă de larvele viermii de mătase. Conține fibre structurale scurte constând din aminoacizi cu o mase mică și lungimea moleculei. Acestea sunt, în primul rând, serină, alanină și glicină. Lanțurile sale polipeptidice sunt orientate în spațiu într-o direcție verticală și orizontală. Substanța este o polipeptidă structurală și are o formă stratificată. Spre deosebire de polipeptide globulare solubilitatea proteinei constând din fibrilelor este foarte mic, deoarece radicalii hidrofobi ai acizilor amino sunt pe suprafață și particulele macromoleculă resping solvent polar.

Keratin și caracteristicile structurii lor
Luând în considerare grupul structural proteine fibrilare forme, cum ar fi fibroina și colagenul, este necesar să se oprească la una mai răspândită în grupul natural de peptide - keratina. Ele servesc drept bază pentru astfel de părți ale corpului uman și animale precum părul, cuiele, pene, lână, copite și gheare. Ce este keratina din punct de vedere al structurii biochimice? Se constată că există două tipuri de peptide. Primul are forma unei structuri secundare spirala (alfa-keratina) si este baza parului. Celălalt este reprezentat de fibrile stratificate mai lungi - acest lucru beta - keratina. Se regăsește în părțile solide ale corpului animalelor: copite, ciocuri de păsări, câini de reptile, gheare de mamifere și păsări. Ce este keratina, pe baza faptului că aminoacizii ei, de exemplu, cum ar fi valina, fenilalanina, izoleucina, conțin un număr mare de radicali hidrofobi? Este o proteină insolubilă în apă și alți solvenți polari, având o funcție protectoare și structurală.
Efectul pH-ului mediului asupra sarcinii polimerului proteic
Anterior, am menționat că grupurile funcționale de monomeri proteici - aminoacizi, determină proprietățile lor. Acum adaugam ca si sarcina polimerului depinde si de ele. Radicalii ionogeni - grupările carboxil ale acidului glutamic și aspartic și gruparea amino a argininei și histidinei afectează sarcina totală a polimerului. De asemenea, ele se comportă diferit într-un mediu acid, neutru sau alcalin. De asemenea, solubilitatea proteinei depinde de acești factori. Astfel, la pH<7, soluția conține o concentrație excesivă de protoni de hidrogen, care inhibă scindarea carboxilului, astfel încât sarcina totală pozitivă asupra moleculei de proteină crește.

Acumularea de cationi în proteină crește, de asemenea, în cazul unui mediu de soluție neutră și cu un exces de monomeri ai argininei, histidinei și lizinei. Într-un mediu alcalin, apare o creștere a încărcării negative a moleculei de polipeptidă, deoarece excesul de ioni de hidrogen este utilizat pentru formarea moleculelor de apă prin legarea grupărilor hidroxil.
Factorii care determină solubilitatea proteinelor
Să ne imaginăm o situație în care numărul încărcăturilor pozitive și negative pe o helix proteic este același. PH-ul mediului în acest caz se numește punctul izoelectric. Încărcarea totală a macromoleculei peptidei în sine devine zero și solubilitatea acesteia în apă sau în alt solvent polar va fi minimă. Pozițiile teoriei disocierii electrolitice afirmă acest lucru solubilitatea materiei într-un solvent polar format din dipoli, cu atât mai mare va fi cea mai polarizată particulele compusului solubil. Ei explică, de asemenea, factorii care determină solubilitatea proteinelor: punctul lor izoelectric și dependența hidratării sau solvației peptidei de sarcina totală a macromoleculei sale. Majoritatea polimerilor din această clasă conțin un exces de -COO- și au proprietăți ușor acide. Excepția va fi menționată anterior proteinele membranare și peptidele care alcătuiesc substanța nucleară a eredității sunt cromatina. Acestea din urmă sunt numite histone și au proprietăți de bază pronunțate datorită prezenței unui număr mare de grupe amino în lanțul polimeric.

Comportamentul proteinelor într-un câmp electric
Pentru scopuri practice, este adesea nevoie să se separe, de exemplu, proteinele din sânge, în fracții sau macromolecule individuale. Pentru aceasta, se poate folosi capacitatea moleculelor polimerului încărcat de a se deplasa cu o anumită rată la electrozi într-un câmp electric. O soluție care conține diferite peptide de masă și de încărcare este plasată pe un suport: hârtie sau un gel special. Prin trecerea impulsurilor electrice, de exemplu, printr-o porțiune din plasma sanguină, se obțin până la 18 fracțiuni de proteine individuale. Printre ei tot felul de globulină si proteine albumina, care nu este numai o componentă esențială constituent (reprezentând 60% din masa peptidelor din plasma sângelui), dar, de asemenea, joacă un rol central în procesele de osmoza și circulația sângelui.
Cum afectează solubilitatea proteinei concentrația de săruri
Capacitatea peptidelor pentru a forma nu numai geluri, spume și emulsii, soluții, dar și - o proprietate importantă care să reflecte caracteristicile lor fizico-chimice. De exemplu, albumine studiate anterior situate în endospermul semințelor de cereale, lapte si serul sanguin, formează rapid soluții apoase având o concentrație de săruri neutre, cum ar fi clorura de sodiu, în intervalul de la 3 la 10 la sută. Pe exemplul acelorași albumine, se poate determina dependența solubilității proteinei de concentrația de sare. Ele sunt ușor solubile în nesaturata soluția de sulfat de amoniu și într-o suprasaturata - precipitat și reducând în mod reversibil în continuare a concentrației de sare prin adăugarea de porțiuni de apă restaura carapace hidrat.

Salting out
Reacțiile chimice descrise mai sus ale peptidelor cu soluții de săruri formate de acid tare și alcaline se numesc sărăcire. Se bazează pe mecanismul interacțiunii grupurilor funcționale încărcate de proteine cu ioni de sare - cationi metalici și anioni ai resturilor acide. Se termină cu o pierdere de încărcare pe molecula de peptidă, o scădere a învelișului său de apă, aglomerarea particulelor de proteină. Ca urmare, apare depunerea lor, pe care vom trăi mai departe.
Precipitarea și denaturarea
Acetona și alcoolul etilic distrug carcasa de apă care înconjoară proteina din structura terțiară. Cu toate acestea, acest lucru nu este însoțit de neutralizarea taxei totale pe acesta. Un astfel de proces se numește precipitare, solubilitatea proteinei este redusă drastic, dar nu se termină cu denaturarea.

Molecule de peptide prezente în stare nativă, sunt foarte sensibili la mai mulți parametri ai mediului, cum ar fi temperatura și concentrația de compuși chimici, cum ar fi săruri, acizi sau alcali. Potențarea ambii acești factori în punctul izoelectric ca rezultat distrugerea completă a intramoleculare stabilizatoare (punți disulfidice, peptida de legătură), legături covalente și hidrogen în polipeptidă. Deosebit de rapid în aceste condiții, peptidele globulare denaturate, deci pierde complet fizico-chimică și proprietățile biologice.
 Organoidele celulare și funcțiile lor: diversitate, funcții și proprietăți
Organoidele celulare și funcțiile lor: diversitate, funcții și proprietăți Proprietățile fizice ale proteinelor. Cele mai importante proprietăți chimice ale proteinelor
Proprietățile fizice ale proteinelor. Cele mai importante proprietăți chimice ale proteinelor Structura celulei eucariote
Structura celulei eucariote Funcția catalitică a proteinelor: exemple. Principalele funcții ale proteinelor
Funcția catalitică a proteinelor: exemple. Principalele funcții ale proteinelor Monomerii proteinelor sunt ce substanțe? Ce sunt monomeri de proteine?
Monomerii proteinelor sunt ce substanțe? Ce sunt monomeri de proteine? Sinteza proteinelor din celulă, secvența proceselor biosintetice. Sinteza proteinelor pe ribozomi.
Sinteza proteinelor din celulă, secvența proceselor biosintetice. Sinteza proteinelor pe ribozomi. Proteine globulare și fibrilare: caracteristici de bază
Proteine globulare și fibrilare: caracteristici de bază Proteine: clasificarea, structura și funcțiile proteinelor
Proteine: clasificarea, structura și funcțiile proteinelor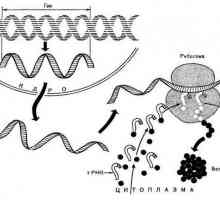 În procesul de sinteză a proteinelor, ce structuri și molecule sunt direct implicate?
În procesul de sinteză a proteinelor, ce structuri și molecule sunt direct implicate? Care este funcția clădirii proteinelor?
Care este funcția clădirii proteinelor? Proteine simple și complexe. Structura, funcții, proprietăți, caracteristici, exemple de proteine…
Proteine simple și complexe. Structura, funcții, proprietăți, caracteristici, exemple de proteine… Funcția de protecție a proteinelor. Structura și funcția proteinelor
Funcția de protecție a proteinelor. Structura și funcția proteinelor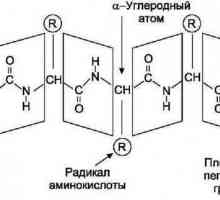 Din moleculele reziduurilor de aminoacizi ale celor construite?
Din moleculele reziduurilor de aminoacizi ale celor construite? Din ce constă proteina? Exemple de proteine simple și complexe
Din ce constă proteina? Exemple de proteine simple și complexe Aminoacizi: biochimie, clasificare
Aminoacizi: biochimie, clasificare Structura aminoacizilor. Determinarea și clasificarea aminoacizilor
Structura aminoacizilor. Determinarea și clasificarea aminoacizilor Proteină fibrilă și globulară, monomer proteic, tipare de sinteză a proteinelor
Proteină fibrilă și globulară, monomer proteic, tipare de sinteză a proteinelor Nivelurile organizării structurale a moleculei de proteine: structura secundară a proteinei
Nivelurile organizării structurale a moleculei de proteine: structura secundară a proteinei Sinteza proteinelor
Sinteza proteinelor Cele mai mari celule de materie organică
Cele mai mari celule de materie organică Schimbul de plastic, esența și rolul său în organism
Schimbul de plastic, esența și rolul său în organism
 Proprietățile fizice ale proteinelor. Cele mai importante proprietăți chimice ale proteinelor
Proprietățile fizice ale proteinelor. Cele mai importante proprietăți chimice ale proteinelor Funcția catalitică a proteinelor: exemple. Principalele funcții ale proteinelor
Funcția catalitică a proteinelor: exemple. Principalele funcții ale proteinelor Monomerii proteinelor sunt ce substanțe? Ce sunt monomeri de proteine?
Monomerii proteinelor sunt ce substanțe? Ce sunt monomeri de proteine? Sinteza proteinelor din celulă, secvența proceselor biosintetice. Sinteza proteinelor pe ribozomi.
Sinteza proteinelor din celulă, secvența proceselor biosintetice. Sinteza proteinelor pe ribozomi. Proteine globulare și fibrilare: caracteristici de bază
Proteine globulare și fibrilare: caracteristici de bază Proteine: clasificarea, structura și funcțiile proteinelor
Proteine: clasificarea, structura și funcțiile proteinelor În procesul de sinteză a proteinelor, ce structuri și molecule sunt direct implicate?
În procesul de sinteză a proteinelor, ce structuri și molecule sunt direct implicate? Care este funcția clădirii proteinelor?
Care este funcția clădirii proteinelor? Proteine simple și complexe. Structura, funcții, proprietăți, caracteristici, exemple de proteine…
Proteine simple și complexe. Structura, funcții, proprietăți, caracteristici, exemple de proteine…