Caracteristicile legăturii covalente. Pentru care substanțele este o legătură covalentă
De ce atomii se pot conecta unul la altul și formează molecule? Care este motivul posibilei existențe a substanțelor care conțin atomi de elemente chimice complet diferite? Acestea sunt aspecte globale care afectează conceptele fundamentale ale științei fizice și chimice moderne. Puteți să le răspundeți prin faptul că aveți o idee despre structura electronică a atomilor și despre cunoașterea caracteristicilor legăturii covalente, care este baza pentru majoritatea claselor de compuși. Scopul articolului nostru este familiarizarea cu mecanismele de formare a diferitelor tipuri de legături chimice și caracteristicile proprietăților compușilor care le conțin în moleculele lor.
conținut
- Structura electronică a atomului
- Proprietatea de bază a atomilor
- Mecanisme pentru formarea unei configurații electronice stabile
- Generale perechi electronice
- Proprietățile fizice ale legăturii covalente
- Forma spațială a unei molecule
- Structura substanțelor simple - nemetalice
- Electronegativitatea și efectul acesteia asupra tipului de legătură chimică
- Caracteristicile compușilor cu comunicare polară
- Metode de rupere a legăturilor chimice
- Legături duble și triple

Structura electronică a atomului
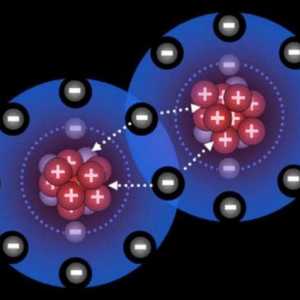
Particulele neutre ale materiei, care sunt elementele sale structurale, au o structură care reflectă structura sistemului solar. Pe măsură ce planetele se rotesc în jurul stelei centrale - Soarele și electronii din atom se mișcă în jurul nucleului încărcat pozitiv. Pentru a caracteriza legătura covalentă, electronii localizați la ultimul nivel de energie și cei mai îndepărtați de nucleu vor fi semnificativi. Deoarece legătura lor cu centrul atomului lor este minimă, ele pot fi ușor atrase de nucleele altor atomi. Acest lucru este foarte important pentru apariția interacțiunilor interatomice care conduc la formarea de molecule. De ce este forma moleculară principalul tip de existență a materiei pe planeta noastră? Să ne dăm seama.

Proprietatea de bază a atomilor
Abilitatea particulelor neutre din punct de vedere electric de a interacționa, ceea ce duce la o creștere a energiei, este caracteristica cea mai importantă. În condiții obișnuite, starea moleculară a substanței este mai stabilă decât cea atomică. Principiile de bază ale predării moleculare atomice moderne explică atât principiile formării moleculelor, cât și caracteristicile legăturii covalente. Reamintim că la nivelul energiei externe a atomului poate fi de la 1 la 8 electroni, în cel de-al doilea caz stratul va fi finalizat și, prin urmare, foarte stabil. O astfel de structură la nivel extern are atomi de gaze nobile: argon, krypton, xenon - elemente inerte care completează fiecare perioadă din sistemul DI Mendeleyev. Excepția aici este heliul, care la ultimul nivel nu este 8, dar numai 2 electroni. Motivul este simplu: în prima perioadă există doar două elemente ale căror atomi au un singur strat electronic. Toate celelalte elemente chimice au 1 până la 7 electroni pe ultimul strat incomplet. În procesul de interacțiune între ei, atomii vor avea tendința de a umple cu electroni un octet și de a restabili configurația atomului elementului inert. O astfel de stare poate fi realizată în două moduri: prin pierderea propriului sau prin acceptarea unor particule încărcate negativ. Aceste forme de interacțiune explică modul de determinare a legăturii - ionice sau covalente - care va apărea între reacția atomilor.

Mecanisme pentru formarea unei configurații electronice stabile
Să ne imaginăm că două substanțe simple se alătură reacției compusului: sodiu metalic și clor gazos. Se formează o substanță din clasa de săruri - clorură de sodiu. Are un tip ionic de legătură chimică. De ce și cum sa întâmplat? Să ne întoarcem din nou la structura atomilor substanțelor inițiale. Sodiul are un singur electron pe ultimul strat, care este slab legat de nucleu din cauza razei mari a atomului. Energia de ionizare pentru toate metalele alcaline, inclusiv sodiul, este mică. Prin urmare, electronul de nivel exterior părăsește nivelul energiei, este atras de nucleul atomului de clor și rămâne în spațiul său. Aceasta creează un precedent pentru trecerea atomului de Cl la forma unui ion încărcat negativ. Acum nu avem de-a face cu particule neutre din punct de vedere electric, ci cu cationi de sodiu încărcați și anioni de clor. În conformitate cu legile fizicii dintre ele apar forțele de atracție electrostatică, iar compusul formează o latură de cristal ionic. Mecanismul de formare a tipului ionic de legătură chimică considerat de noi ne va ajuta să clarificăm mai clar specificul și caracteristicile de bază ale legăturii covalente.
Generale perechi electronice
Dacă legătura ionică are loc între atomii de elemente care sunt electronegativitate foarte diferite, t. E. Metale și nemetale, tipul covalentă apare în interacțiunea atomilor ca identice sau diferite elemente nemetalice. În primul caz, se obișnuiește să se vorbească de un non-polar, iar celălalt - pe o legătură covalentă polară. Mecanismul formării lor comun: fiecare dintre atomii din parțial trimite un electroni generale de utilizare care sunt combinate pairwise. Dar aranjamentul spațial al perechilor de electroni față de nucleele atomice va fi inegal. Pe această bază și să facă distincția între tipurile de legături covalente - polare și non-polare. Cel mai adesea în compuși chimici care constau din atomi de elemente nemetalice apar pereche constând din electroni cu spin opus, t. E. revolving în jurul nucleele lor în direcții opuse. Deoarece mișcarea particulelor încărcate negativ în spațiul duce la formarea norilor de electroni care se termină în cele din urmă cu suprapunere reciprocă a acestora. Care sunt consecințele acestui proces pentru atomi și ce duce la acestea?
Proprietățile fizice ale legăturii covalente
Se pare că un nor de două electroni cu o densitate mare apare între centrele a doi atomi interacțioși. Forțele electrostatice de atracție dintre norul încărcat negativ și nucleele atomilor cresc. Porțiunea de energie este eliberată și distanțele dintre centrele atomice sunt reduse. De exemplu, la începutul formării moleculei H2 distanța dintre nucleele atomilor de hidrogen este 1,06 A, iar după formarea norilor se suprapun perechi de electroni comune - 0,74 A. Exemple de legătura covalentă care se formează prin mecanismul descris mai sus poate fi găsit printre simple și complexe între substanțele anorganice. Caracteristica principală a acesteia este prezența unor perechi electronice comune. Ca urmare, după apariția unei legături covalente între atomii de carbon, de exemplu, hidrogen, fiecare dintre ele capătă configurația electronică a unui heliu inert și molecula formată are o structură stabilă.

Forma spațială a unei molecule
O altă proprietate fizică foarte importantă a legăturii covalente este directivitatea. Depinde de configurația spațială a moleculei materiei. De exemplu, atunci când doi electroni se suprapun cu o formă de nor sferic, forma moleculei este liniară (acid clorhidric sau bromhidrat). Forma moleculelor de apă în care s-au hibridizat norii s și p sunt unghiulare, iar particulele foarte puternice de azot gazos au forma unei piramide.
Structura substanțelor simple - nemetalice
Descoperind ce legătură se numește covalent, ce semne are, acum este timpul să-i rezolvăm soiurile. În cazul în care atomii aceluiași nonmetal - clor, azot, oxigen, brom, etc. intră în interacțiunea dintre ele, se formează substanțele simple corespunzătoare. Perele lor de electroni obișnuiți sunt localizați la aceeași distanță față de centrele atomilor, fără a se schimba. Pentru compușii cu un tip de legătură covalent nepolar, astfel de caracteristici sunt inerente: puncte de fierbere scăzute și puncte de topire, insolubilitate în apă și proprietăți dielectrice. Apoi vom afla pentru care substanțe caracteristică este o legătură covalentă, la care se schimbă perechile electronice comune.

Electronegativitatea și efectul acesteia asupra tipului de legătură chimică
Proprietatea unui anumit element de a atrage electroni de la atomul altui element din chimie se numește electronegativitate. Scara acestui parametru, propusă de L. Pauling, poate fi găsită în toate manualele de chimie anorganică și generală. Valoarea sa cea mai mare este de 4,1 eV - are fluor, mai puțin - alte metale active, iar cea mai mică valoare este caracteristică metalelor alcaline. Dacă elementele reacționează unul cu celălalt, caracterizat prin electronegativitate sale, este în mod inevitabil, mai activ, vor fi atrase de nucleu încărcat negativ atom al unui element pasiv. Astfel, proprietățile fizice ale legăturii covalente depind în mod direct de capacitatea elementelor de a da electronilor uz general. Perechile generice formate în acest fel nu mai stau simetric în ceea ce privește nucleele, ci trec spre elementul mai activ.
Caracteristicile compușilor cu comunicare polară
Substanțele ale căror molecule perechi de electroni comune sunt asimetrice în raport cu nucleele atomilor, includ halogenuri de hidrogen, compus calcogen hidrogen de acid și oxizii acizi. Acest sulfat de acid și de nitrat, oxizi de sulf și fosfor, hidrogen sulfurat, și așa mai departe. D. De exemplu, molecula de acid clorhidric cuprinde o pereche de electroni comune formate de electroni nepereche de hidrogen și clor. Este compensat mai aproape de centrul de atomi de Cl fiind elementul mai electronegative. Toate substanțele cu o legătură polară în soluții apoase disociază în ioni și conduc un curent electric. Compușii având polar covalent bond, exemple pe care le-am dat, au puncte de topire și puncte de fierbere mai mari decât cele simple substanțe nemetalice.
Metode de rupere a legăturilor chimice
În chimia organică reacții de substituție limitarea hidrocarburilor cu halogeni trece printr-un mecanism radical. Un amestec de metan și clor în lumină și la temperaturile obișnuite reacționează astfel încât moleculele de clor să înceapă să se împartă în particule care poartă electroni nepartiți. Cu alte cuvinte, perechea electronică totală este distrusă și se observă formarea radicalilor foarte activi-Cl. Ele sunt capabile să afecteze moleculele de metan în așa fel încât să rupă legătura covalentă dintre atomii de carbon și hidrogen. O particulă activă este formată -H, iar valența liberă a atomului de carbon ia radicalul clor și primul produs al reacției este clorometan. Un astfel de mecanism de divizare a moleculelor se numește homolitic. Dacă, totuși, o pereche totală de electroni intră complet în posesia unuia dintre atomi, atunci vorbește despre un mecanism heterolitic caracteristic reacțiilor apărute în soluțiile apoase. În acest caz, moleculele polare ale apei vor spori rata de distrugere a legăturilor chimice ale compusului dizolvat.

Legături duble și triple
Marea majoritate a substanțelor organice și a unor compuși anorganici conțin în moleculele lor nu una, ci mai multe perechi de electroni comune. Multiplicitatea legăturii covalente reduce distanța dintre atomi și crește stabilitatea compușilor. Acestea sunt de obicei discutate ca rezistente chimic. De exemplu, într-o moleculă de azot există trei perechi de electroni, ele sunt indicate în formula structurală prin trei liniuțe și determină rezistența lor. substanță simplă inerte chimic și azot pot reacționa cu alți compuși, cum ar fi hidrogenul, oxigenul sau metalele numai prin încălzire sau presiune ridicată și în prezența catalizatorilor.

Legăturile duble și triple sunt inerente unor astfel de clase de compuși organici, cum ar fi hidrocarburile dienice nesaturate, precum și substanțele dintr-o serie de etilenă sau acetilenă. Legăturile multiple determină proprietățile chimice de bază: reacțiile de adiție și de polimerizare care apar în punctele de rupere.
În articolul nostru am dat o descriere generală a legăturii covalente și am examinat principalele sale tipuri.
 Ce constă în apă: din care molecule și atomi
Ce constă în apă: din care molecule și atomi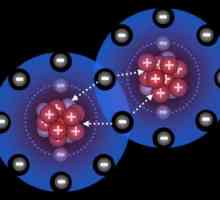 Mecanismul donator-acceptor: exemple. Ce este un mecanism donator-acceptor?
Mecanismul donator-acceptor: exemple. Ce este un mecanism donator-acceptor? Ce este o substanță complexă? Cum se întâmplă?
Ce este o substanță complexă? Cum se întâmplă? Organic materia caracteristicile și clasificarea lor
Organic materia caracteristicile și clasificarea lor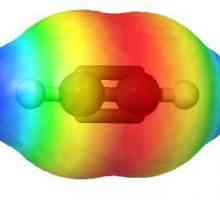 Formula structurală și moleculară: acetilenă
Formula structurală și moleculară: acetilenă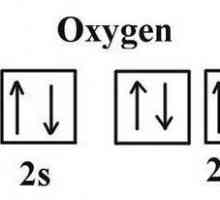 Care este valența de oxigen în compuși?
Care este valența de oxigen în compuși?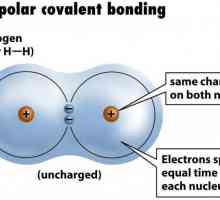 Un exemplu de legătură covalentă nepolară. Legătura covalentă este polară și nepolară
Un exemplu de legătură covalentă nepolară. Legătura covalentă este polară și nepolară Structura spațială a moleculelor de substanțe anorganice și organice
Structura spațială a moleculelor de substanțe anorganice și organice Substanțe anorganice
Substanțe anorganice Structura moleculară are ... Ce substanță are o structură moleculară
Structura moleculară are ... Ce substanță are o structură moleculară Legătura cu hidrogen: exemple și tipuri de legături chimice
Legătura cu hidrogen: exemple și tipuri de legături chimice Principalele tipuri de legături chimice: de ce și cum sunt formate
Principalele tipuri de legături chimice: de ce și cum sunt formate Legătura covalentă
Legătura covalentă Hidrocarburi limită: caracteristici generale, izomerie, proprietăți chimice
Hidrocarburi limită: caracteristici generale, izomerie, proprietăți chimice Structura materiei
Structura materiei Ce este o legătură de hidrogen? Tipuri, influență
Ce este o legătură de hidrogen? Tipuri, influență Ce este o legătură covalentă polară
Ce este o legătură covalentă polară Legarea ionilor
Legarea ionilor Nivelurile energetice externe: trăsăturile structurale și rolul lor în interacțiunile dintre atomi
Nivelurile energetice externe: trăsăturile structurale și rolul lor în interacțiunile dintre atomi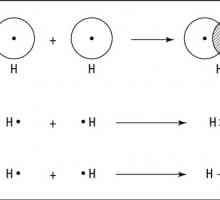 Subiectul și sarcinile chimiei. Chimie generală. Chimie organică
Subiectul și sarcinile chimiei. Chimie generală. Chimie organică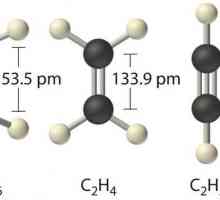 Legătura chimică: definiția, tipurile, clasificarea și caracteristicile definiției
Legătura chimică: definiția, tipurile, clasificarea și caracteristicile definiției
 Mecanismul donator-acceptor: exemple. Ce este un mecanism donator-acceptor?
Mecanismul donator-acceptor: exemple. Ce este un mecanism donator-acceptor? Ce este o substanță complexă? Cum se întâmplă?
Ce este o substanță complexă? Cum se întâmplă? Formula structurală și moleculară: acetilenă
Formula structurală și moleculară: acetilenă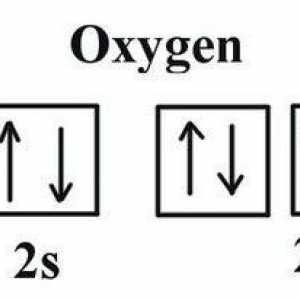 Care este valența de oxigen în compuși?
Care este valența de oxigen în compuși?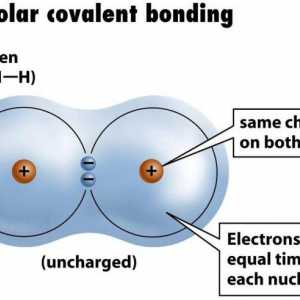 Un exemplu de legătură covalentă nepolară. Legătura covalentă este polară și nepolară
Un exemplu de legătură covalentă nepolară. Legătura covalentă este polară și nepolară Structura spațială a moleculelor de substanțe anorganice și organice
Structura spațială a moleculelor de substanțe anorganice și organice Structura moleculară are ... Ce substanță are o structură moleculară
Structura moleculară are ... Ce substanță are o structură moleculară Legătura cu hidrogen: exemple și tipuri de legături chimice
Legătura cu hidrogen: exemple și tipuri de legături chimice