Dependența ratei de reacție la temperatură. Ecuația lui Arrhenius
Suntem constant confruntați cu diferite interacțiuni chimice. Arderea gazelor naturale, ruginirea fierului, arderea laptelui - nu toate procesele care sunt studiate în detaliu în cursul școlii de chimie.
conținut
Unele reacții necesită fracțiuni de secunde, iar unele interacțiuni necesită zile și săptămâni.
Să încercăm să determinăm dependența ratei de reacție la temperatură, concentrație, alți factori. În noul standard educațional, la această întrebare se acordă o sumă minimă de timp de studiu. În cadrul testelor de examinare de stat unificate sunt sarcini pentru dependența ratei de reacție de temperatură, concentrare și chiar și sarcinile de calcul sunt propuse. Mulți elevi de liceu se confruntă cu anumite dificultăți în a găsi răspunsuri la aceste întrebări, așa că vom analiza acest subiect în detaliu.

Relevanța problemei examinate
Informațiile privind viteza de reacție au o mare importanță practică și științifică. De exemplu, în producția specifică de substanțe și produse dintr-o anumită valoare, performanța echipamentului, valoarea bunurilor depinde direct.
Clasificarea reacțiilor în desfășurare
Există o relație directă între starea agregată a componentelor inițiale și produsele formate în timpul proces chimic: interacțiuni eterogene.
În cadrul sistemului, este obișnuit să se implice o substanță sau o combinație a acestora în chimie.
Omogenează un astfel de sistem, care constă într-o singură fază (aceeași stare agregată). Ca exemplu, putem menționa un amestec de gaze, mai multe lichide diferite.
Heterogen este un sistem în care reactanții sunt sub formă de gaze și lichide, solide și gaze.
Nu este doar o dependență a ratei de reacție de temperatură, ci și a fazei în care se utilizează componentele care intră în interacțiunea analizată.
Pentru o compoziție omogenă, procesul continuă pe întregul volum, ceea ce îmbunătățește semnificativ calitatea acestuia.
Dacă materiile prime sunt în diferite stări de fază, interacțiunea maximă este observată la limita de fază. De exemplu, atunci când metalul activ este dizolvat într-un acid, formarea produsului (sare) se observă numai la suprafața de contact.

Relația matematică dintre viteza procesului și diverși factori
Care este ecuația dependenței ratei de reacție chimică la temperatură? Pentru un proces omogen, rata este determinată de cantitatea de materie care intră în interacțiune sau se formează în timpul reacției în volumul sistemului pe unitate de timp.
Pentru un proces eterogen, viteza este determinată de cantitatea de substanță care reacționează sau este obținută în proces pe unitatea de suprafață pe o perioadă minimă de timp.

Factorii care afectează rata de reacție chimică
Natura substanțelor care reacționează este unul dintre motivele pentru viteza diferită a proceselor. De exemplu, metalele alcaline formează alcaline cu apă la temperatura camerei, iar procesul este însoțit de eliberarea intensivă de hidrogen gazos. Metalele nobile (aur, platină, argint) nu sunt capabile de astfel de procese nici la temperatura camerei, nici sub încălzire.
Natura substanțelor care reacționează este factorul luat în considerare în industria chimică pentru a crește rentabilitatea producției.
A fost descoperită dependența dintre concentrația reactivilor și rapiditatea reacției chimice. Cu cât este mai mare, cu atât mai multe particule se vor ciocni, deci procesul va continua mai repede.
Legea maselor care acționează în formă matematică descrie o relație direct proporțională între concentrația substanțelor inițiale și viteza procesului.
A fost formulată la mijlocul secolului al XIX-lea de chimistul rus NN Beketov. Pentru fiecare proces, se determină o constantă de reacție, care nu este legată nici de temperatura, concentrație, nici de natura reactanților.
Pentru a accelera reacția în care este implicat un solid, este necesar să-l rafinați într-o stare pulverulentă.
Acest lucru crește suprafața, ceea ce afectează în mod pozitiv viteza procesului. Pentru motorina, se utilizează un sistem special de injecție, astfel încât atunci când vine în contact cu aerul, rata de ardere a unui amestec de hidrocarburi crește substanțial.

încălzire
Dependența ratei de reacție chimică la temperatură este explicată de teoria moleculare-cinetică. Ea face posibilă calcularea numărului de coliziuni între moleculele de reactivi în anumite condiții. Dacă vă armonizați cu astfel de informații, atunci în condiții normale toate procesele ar trebui să se desfășoare instantaneu.
Dar, dacă luăm în considerare un exemplu specific al dependenței ratei de reacție de temperatură, se pare că pentru interacțiune este necesar mai întâi să se rupă legăturile chimice dintre atomi, astfel încât să se formeze noi substanțe din ele. Aceasta necesită o cantitate semnificativă de energie. Care este dependența ratei de reacție de temperatura? Energia de activare determină posibilitatea ruperii moleculare, și anume, ea caracterizează realitatea proceselor. Unitățile sale de măsură sunt kJ / mol.
Dacă indicele de energie este insuficient, coliziunea va fi ineficientă, deci nu este însoțită de formarea unei noi molecule.

Reprezentare grafică
Dependența ratei reacției chimice la temperatură poate fi reprezentată grafic. Când este încălzit, numărul de coliziuni dintre particule crește, ceea ce contribuie la accelerarea interacțiunii.
Cum depinde graficul vitezei de reacție de temperatura? Energia moleculelor este stabilită pe orizontală, iar numărul de particule cu o rezervă de energie ridicată este indicat vertical. Graficul este o curbă, din care se poate judeca viteza unei anumite interacțiuni.
Cu cât este mai mare diferența de energie față de medie, cu atât mai mult este punctul de curbă din punct de vedere al maximului, iar procentul mai mic de molecule are o astfel de sursă de energie.

Aspecte importante
Este posibil să se scrie ecuația dependenței constantei vitezei de reacție de temperatura? Creșterea sa reflectă creșterea vitezei procesului. Această dependență se caracterizează printr-o anumită valoare, numită coeficientul de temperatură al vitezei procesului.
Pentru orice interacțiune, constanta vitezei de reacție se depinde de temperatura. Dacă crește cu 10 grade, viteza procesului crește cu un factor de 2-4.
Dependența ratei de reacții omogene asupra temperaturii poate fi reprezentată în formă matematică.
Pentru majoritatea interacțiunilor la temperatura camerei, coeficientul este în intervalul de la 2 la 4. De exemplu, cu un coeficient de temperatură de 2,9, o creștere a temperaturii de 100 de grade accelerează procesul de aproape 50 000 de ori.
Dependența ratei de reacție asupra temperaturii poate fi ușor explicată prin diferite valori ale energiei de activare. Are o valoare minimă atunci când efectuează procese ionice, care sunt determinate numai de interacțiunea dintre cationi și anioni. Numeroase experimente indică apariția instantanee a unor astfel de reacții.
La o valoare ridicată a energiei de activare, doar un număr mic de coliziuni între particule vor duce la interacțiune. Cu o medie de energie de activare, reactivii vor interacționa cu viteza medie.
Atribuțiile la dependența ratei de reacție de concentrație și temperatură sunt luate în considerare numai în stadiul superior al instruirii, duc adesea la dificultăți grave pentru copii.
Măsurarea vitezei procesului
Aceste procese care necesită o energie semnificativă de activare sugerează o ruptură inițială sau o slăbire a legăturilor dintre atomii din materiile prime. În același timp, aceștia intră într-o anumită stare intermediară, numită complex activat. Este o stare instabilă, se dizolvă destul de repede în produse de reacție, procesul este însoțit de eliberarea de energie suplimentară.
În cea mai simplă formă, complexul activ este o configurație a atomilor cu legături vechi atenuate.

Inhibitori și catalizatori
Să analizăm dependența ratei reacției enzimatice față de temperatura mediului. Astfel de substanțe acționează ca acceleratori de proces.
Ei înșiși nu participă la interacțiune, numărul acestora rămâne neschimbat după finalizarea procesului. Dacă catalizatorii contribuie la o creștere a vitezei de reacție, atunci inhibitorii, dimpotrivă, încetinesc acest proces.
Esența acestui fapt este formarea compușilor intermediari, ca rezultat al modificării vitezei procesului.
concluzie
În lume în fiecare minut există diferite interacțiuni chimice. Cum se stabilește dependența ratei de reacție la temperatură? Ecuația Arrhenius este o explicație matematică a relației dintre constanta ratei și temperatura. Oferă o idee despre acele valori ale energiei de activare la care distrugerea sau slăbirea legăturilor dintre atomi în molecule, distribuția particulelor în substanțe chimice noi este posibilă.
Datorită teoriei moleculare-cinetice, este posibil să se prezică probabilitatea interacțiunilor dintre componentele inițiale și să se calculeze viteza procesului. Printre factorii care influențează rata de reacție, schimbarea indicelui de temperatură, concentrația procentuală a substanțelor interacționante, suprafața de contact, prezența catalizatorului (inhibitor) și natura componentelor care interacționează sunt de o importanță deosebită.
 Reacția compusului: Exemple și formule
Reacția compusului: Exemple și formule Echilibrul chimic: constanta echilibrului chimic și modalitățile de exprimare a acestuia
Echilibrul chimic: constanta echilibrului chimic și modalitățile de exprimare a acestuia Reacțiile heterogene sunt simple și ușor de înțeles!
Reacțiile heterogene sunt simple și ușor de înțeles! Sisteme eterogene sau heterogene
Sisteme eterogene sau heterogene Principiul Le Chatelier: o descoperire științifică a secolului al XVIII-lea
Principiul Le Chatelier: o descoperire științifică a secolului al XVIII-lea Reacții omogene.
Reacții omogene. Cum se compune o ecuație chimică: reguli, exemple. Înregistrarea reacției chimice
Cum se compune o ecuație chimică: reguli, exemple. Înregistrarea reacției chimice Centrul activ al enzimei: structura, proprietățile. Cine a descoperit centrul activ al enzimei? Ce…
Centrul activ al enzimei: structura, proprietățile. Cine a descoperit centrul activ al enzimei? Ce… Nitrarea toluenului: ecuația de reacție
Nitrarea toluenului: ecuația de reacție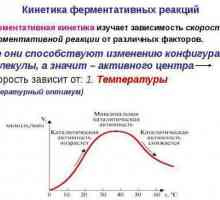 Kinetica reacțiilor enzimatice - descriere, caracteristici și tabel
Kinetica reacțiilor enzimatice - descriere, caracteristici și tabel Arderea metanului
Arderea metanului Punct de aprindere
Punct de aprindere Cum funcționează reacția de ardere?
Cum funcționează reacția de ardere? Energie de activare
Energie de activare Factorii care afectează rata de reacție chimică
Factorii care afectează rata de reacție chimică Algoritmi pentru rezolvarea problemelor - caracteristici, descriere pas cu pas și recomandări
Algoritmi pentru rezolvarea problemelor - caracteristici, descriere pas cu pas și recomandări Cum să aranjăm coeficienții în ecuațiile chimice? Ecuatii chimice
Cum să aranjăm coeficienții în ecuațiile chimice? Ecuatii chimice O reacție catalitică este ce? Principii și tipuri de bază
O reacție catalitică este ce? Principii și tipuri de bază Ordinea de reacție: concept, tipuri
Ordinea de reacție: concept, tipuri Purificarea catalitică a emisiilor de gaze
Purificarea catalitică a emisiilor de gaze Ecuația reacției chimice - înregistrarea reacției chimice condiționate
Ecuația reacției chimice - înregistrarea reacției chimice condiționate
 Echilibrul chimic: constanta echilibrului chimic și modalitățile de exprimare a acestuia
Echilibrul chimic: constanta echilibrului chimic și modalitățile de exprimare a acestuia Cum se compune o ecuație chimică: reguli, exemple. Înregistrarea reacției chimice
Cum se compune o ecuație chimică: reguli, exemple. Înregistrarea reacției chimice Centrul activ al enzimei: structura, proprietățile. Cine a descoperit centrul activ al enzimei? Ce…
Centrul activ al enzimei: structura, proprietățile. Cine a descoperit centrul activ al enzimei? Ce… Nitrarea toluenului: ecuația de reacție
Nitrarea toluenului: ecuația de reacție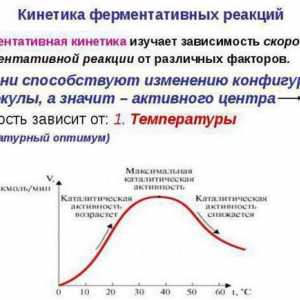 Kinetica reacțiilor enzimatice - descriere, caracteristici și tabel
Kinetica reacțiilor enzimatice - descriere, caracteristici și tabel