Solubilitatea substanțelor: tabel. Solubilitatea substanțelor în apă
În viața de zi cu zi, oamenii întâlnesc rareori substanțe pure.
conținut
- Solubilitatea substanțelor: ce este și de ce?
- Ceea ce este indicat prin măsurarea solubilității materiei
- Solvenți
- Cum să distingem o soluție saturată de o soluție nesaturată?
- Teorii ale interacțiunii componentelor soluției
- Factori care afectează solubilitatea substanțelor
- De ce trebuie să cunoașteți solubilitatea solidelor în apă?
- Ecuațiile reacției chimice
- Tabelul de solubilitate
- Cum se utilizează tabelul de solubilitate al substanțelor?
- Un exemplu simplu
- Concluzie
O soluție este un amestec omogen, în care componentele sunt amestecate uniform. Există mai multe tipuri de ele în ceea ce privește dimensiunea particulelor: sisteme cu dispersie grosieră, soluții moleculare și sisteme coloidale, adesea denumite soluri. Acest articol se ocupă cu molecula (sau adevărate) soluții. Solubilitatea substanțelor în apă este una dintre principalele condiții care afectează formarea compușilor.
Solubilitatea substanțelor: ce este și de ce?
Pentru a înțelege acest subiect, trebuie să știți care sunt soluțiile și solubilitatea substanțelor. În limbajul simplu, abilitatea unei substanțe de a se conecta cu alta și de a forma este una omogen. Dacă abordați din punct de vedere științific, puteți lua în considerare o definiție mai complexă. Solubilitatea substanțelor este capacitatea lor de a forma cu una sau mai multe substanțe compoziții omogene (sau eterogene) cu o distribuție dispersată a componentelor. Există mai multe clase de substanțe și compuși:
- solubil;
- slab solubil;
- insolubil.

Ceea ce este indicat prin măsurarea solubilității materiei
Conținutul unei substanțe într-un amestec saturat este o măsură a solubilității sale. După cum sa menționat mai sus, pentru toate substanțele este diferită. Solubil - acestea sunt cele care pot dilua mai mult de 10 g de la sine pe 100 g de apă. A doua categorie este mai mică de 1 g în aceleași condiții. Practic insolubil - acelea în care un amestec trece mai puțin de 0,01 g din component. În acest caz, substanța nu își poate transfera moleculele în apă.
Care este coeficientul de solubilitate
Coeficientul de solubilitate (k) este un indicator al masei maxime a unei substanțe (g) care se poate dizolva în 100 g de apă sau altă substanță.
solvenți
Solventul și substanța dizolvată sunt implicați în acest proces. Primul diferă prin faptul că, inițial, se află în aceeași stare agregată cu amestecul final. De regulă, este luată într-o cantitate mai mare.
Cu toate acestea, mulți știu că apa ocupă un loc special în chimie. Există reguli separate pentru aceasta. O soluție în care H este prezent2O se numește apă. Când vorbim despre ele, lichidul este un extractant chiar și atunci când este în cantitate mai mică. Un exemplu este soluția de acid azotic 80% în apă. Proporțiile nu sunt egale aici. Deși proporția de apă este mai mică decât acizii, substanța se numește în mod incorect o soluție de apă de 20% în acid azotic.
Există amestecuri în care nu există H2O. Vor avea un nume fără apă. Astfel de soluții de electroliți sunt conductori ionici. Acestea conțin unul sau un amestec de extractanți. Compoziția lor include ioni și molecule. Acestea sunt utilizate în industrii precum medicina, produse chimice de uz casnic, cosmetice și alte domenii. Pot combina mai multe substanțe necesare cu solubilitate diferită. Componentele multor agenți care se aplică extern sunt hidrofobi. Cu alte cuvinte, ele nu interacționează bine cu apa. În astfel de amestecuri, solvenții pot fi volatili, ne-volatili și combinați. Substanțele organice în primul caz dizolvă ușor grăsimile. Volatilele includ alcooli, hidrocarburi, aldehide și altele. Ele sunt adesea o parte a produselor chimice de uz casnic. Nonvolatile sunt cel mai adesea folosite pentru a face unguente. Acestea sunt uleiuri grase, parafină lichidă, glicerină și altele. Combinat - un amestec de volatile și non-volatile, cum ar fi etanolul, glicerina, glicerina Dimexidum. Ele pot conține și apă.
Tipuri de soluții după gradul de saturație
O soluție saturată este un amestec de substanțe chimice care conțin concentrația maximă a unei substanțe într-un solvent la o anumită temperatură. Atunci nu se va divorța. În pregătire solide precipitarea considerabilă a precipitatului, care este în echilibru dinamic cu acesta. Acest termen înseamnă o stare care persistă în timp ca urmare a fluxului său simultan în două direcții opuse (reacții directe și inverse) cu aceeași viteză.
Dacă substanța la o temperatură constantă se poate descompune, atunci această soluție este nesaturată. Ele sunt stabile. Dar dacă aceștia continuă să adauge substanța, vor fi diluați în apă (sau într-un alt lichid) până când ajunge la concentrația maximă.
O altă specie este suprasaturată. Conține mai multă substanță solubilă decât poate fi la o temperatură constantă. Datorită faptului că sunt într-un echilibru instabil, când sunt afectați fizic, ele cristalizează.
Cum să distingem o soluție saturată de o soluție nesaturată?
E destul de ușor. Dacă substanța este solidă, atunci se poate observa un precipitat într-o soluție saturată. În acest caz, agentul de extracție se poate îngroșa, cum ar fi, de exemplu, într-o compoziție saturată, apă, în care s-a adăugat zahăr.
Dar dacă condițiile sunt schimbate, temperatura este ridicată, atunci nu va mai fi considerată saturate, deoarece la o temperatură mai mare concentrația maximă a acestei substanțe va fi diferită.
Teorii ale interacțiunii componentelor soluției
Există trei teorii privind interacțiunea elementelor din amestec: fizic, chimic și modern. Autorii primelor sunt Svante August Arrhenius și Wilhelm Friedrich Ostwald. Ei au sugerat că, datorită difuziei, particulele solventului și substanța dizolvată au fost distribuite uniform pe întregul volum al amestecului, dar nu a existat nici o interacțiune între ele. Teoria chimică, înaintată de Dmitri Ivanovici Mendeleyev, este contrariul. Potrivit acesteia, ca urmare a interacțiunii chimice dintre acestea, se formează compuși instabili de compoziție constantă sau variabilă, numiți solvați.
Acesta este utilizat în prezent teoria unificată Kistyakovsky Vladimir Alexandrovici și Ivan Kablukova. Combină fizic și chimic. Statele moderne teoria că există ca particule de substanțe care nu interacționează în soluție, și produse de interacțiune a acestora - solvații, care s-au dovedit existența Mendeleev. În cazul în care extractantul este apă, se numesc hidrați. Fenomenul în care se formează solvații (hidrații) se numește solvatare (hidratare). Ea îi afectează pe toți fizice și chimice și modifică proprietățile moleculelor din amestec. Solvatare se datorează faptului că învelișul solvatare constând din molecule extractant strâns înrudite din jurul moleculei solut.
Factori care afectează solubilitatea substanțelor
Compoziția chimică a substanțelor. Regula "cum ar atrage ca" se extinde la reactivi. Substanțe similare în proprietăți fizice și chimice se pot dizolva reciproc mai repede. De exemplu, compușii nepolari interacționează bine cu compușii nepolari. Substanțele cu molecule polare sau structuri ionice sunt crescute în polar, de exemplu, în apă. Se descompune săruri, alcalii și alte componente, și nepolar - dimpotrivă. Puteți da un exemplu simplu. Pentru a prepara o soluție saturată de zahăr în apă, mai multă substanță este necesară decât în cazul sarei. Cum trebuie înțeleasă aceasta? Pur și simplu puneți, puteți dilua mult mai mult zahăr în apă decât sarea.
Temperatura. Pentru a mări solubilitatea solidelor în lichide, este necesară creșterea temperaturii extractant (în multe cazuri). Puteți demonstra acest exemplu. Dacă puneți un vârf de clorură de sodiu (sare) în apă rece, atunci acest proces va dura mult timp. Dacă faceți același lucru cu un mediu fierbinte, dizolvarea va continua mult mai repede. Acest lucru se datorează faptului că, datorită creșterii temperaturii crește energia cinetică, care este adesea o cantitate semnificativă este cheltuită pentru distrugerea legăturilor dintre moleculele și ionii solide. Cu toate acestea, atunci când temperatura crește în cazul litiului, magneziului, aluminiului și sărurilor alcaline, solubilitatea lor scade.
Presiune. Acest factor afectează numai gazele. Solubilitatea lor crește odată cu creșterea presiunii. La urma urmei, volumul de gaze este redus.
Modificarea ratei dizolvării
Nu confunda acest lucru cu solubilitatea. La urma urmei, schimbarea acestor doi indicatori este influențată de diferiți factori.
Grad de fragmentare a substanței dizolvate. Acest factor afectează solubilitatea solidelor în lichide. În întreaga stare (lump), compoziția este crescută mai mult decât cea care este spartă în bucăți mici. Să dăm un exemplu. O singură bucată de sare se va dizolva în apă mult mai mult decât sarea sub formă de nisip.
Viteza de agitare. După cum se știe, acest procedeu poate fi catalizat prin agitare. Viteza sa este de asemenea importantă, deoarece cu cât este mai mult, cu atât substanța se dizolvă mai repede în lichid.
De ce trebuie să cunoașteți solubilitatea solidelor în apă?
În primul rând, este necesară o astfel de schemă pentru rezolvarea corectă a ecuațiilor chimice. În tabelul de solubilitate există taxe pentru toate substanțele. Ei trebuie să fie cunoscuți pentru înregistrarea corectă a reactivilor și formularea ecuației reacției chimice. Solubilitatea în apă indică dacă sarea sau baza pot disocia. Compușii de apă care conduc curentul au compuși electroliți puternici. Există un alt tip. Cei care nu conduc curentul sunt considerați electroliți slabi. În primul caz, componentele sunt substanțe complet ionizate în apă. În timp ce electroliții slabi arată acest indice doar într-o mică măsură.
Ecuațiile reacției chimice
Există mai multe tipuri de ecuații: moleculară, ionică completă și ionică scurtă. De fapt, ultima opțiune - o formă redusă de moleculă. Acesta este răspunsul final. În ecuația completă, se înregistrează reactivii și produsele de reacție. Acum este rândul tabelului de solubilitate al substanțelor. În primul rând, trebuie să verificăm dacă reacția este fezabilă, adică dacă este îndeplinită una dintre condițiile de realizare a reacției. Singura lor 3: formarea apei, eliberarea gazului, precipitații. Dacă primele două condiții nu sunt îndeplinite, trebuie să le verificați. Pentru a face acest lucru, examinați tabelul de solubilitate și aflați dacă există o sare sau o bază insolubilă în produsele de reacție. Dacă este, atunci va fi un sediment. Apoi, tabelul este necesar pentru a scrie ecuația ionului. Deoarece toate sărurile și bazele solubile sunt electroliți puternici, se vor deforma în cationi și anioni. Se taie ioni neviabili și ecuația este scrisă într-o formă scurtă. exemplu:
- K2SO4+BaCl2= BaS024darr- + 2HCI,
- 2K + 2SO4+Ba + 2CI = BaS024darr- + 2K + 2CI,
- Ba + SO4 = BaS024darr-.
Astfel, tabelul de solubilitate al substanțelor este una din condițiile-cheie pentru rezolvarea ecuațiilor ionice.
Un tabel detaliat vă ajută să aflați cât de mult din componenta trebuie să luați pentru a pregăti un amestec saturat.
Tabelul de solubilitate
Aceasta este masa obișnuită incompletă. Este important ca temperatura apei să fie indicată aici, deoarece este unul dintre factorii menționați mai sus.

Cum se utilizează tabelul de solubilitate al substanțelor?
Tabela de solubilitate a substanțelor din apă este unul dintre principalii ajutători ai unui chimist. Ea arată modul în care diferite substanțe și compuși interacționează cu apa. Solubilitatea solidelor într-un lichid este un indicator, fără de care multe manipulări chimice sunt imposibile.
Tabelul este foarte ușor de utilizat. Prima linie conține cationi (particule încărcate pozitiv), în al doilea - anioni (particule încărcate negativ). Majoritatea mesei este ocupată de o rețea cu anumite simboluri în fiecare celulă. Acestea sunt literele "P", "M", "H" și semnele ";" și "?".
- "P" - compusul se dizolvă;
- "M" - puțin solubil;
- "H" - nu se dizolvă;
- ";" - conexiunea nu există;
- "?" - nu există informații privind existența conexiunii.
În acest tabel există o celulă goală - aceasta este apa.
Un exemplu simplu
Acum, despre cum să lucrați cu astfel de materiale. Să presupunem că trebuie să știți dacă solubil în solubil în apă - MgSo4 (sulfat de magneziu). Pentru aceasta este necesar să se găsească coloana Mg2+ și coborâți pe ea pe linia SO42-. La intersecția lor este litera P, astfel încât compusul este solubil.
concluzie
Deci, am studiat problema solubilității substanțelor în apă și nu numai. Fără îndoială, această cunoaștere va fi utilă în studiul în continuare al chimiei. La urma urmei, solubilitatea substanțelor joacă un rol important acolo. Este utilă pentru rezolvarea atât a ecuațiilor chimice cât și a diferitelor probleme.
 Miscarea lui Brown: informatii generale.
Miscarea lui Brown: informatii generale. Substanțe și amestecuri pure. Metode de separare a amestecurilor
Substanțe și amestecuri pure. Metode de separare a amestecurilor Biotransformarea este ceea ce?
Biotransformarea este ceea ce? Proprietăți fizice și chimice unice ale apei
Proprietăți fizice și chimice unice ale apei Concentrația de moleculă. Care este concentrația molară și molară?
Concentrația de moleculă. Care este concentrația molară și molară? Argila în apă se dizolvă sau nu. Solubilitatea diferitelor substanțe
Argila în apă se dizolvă sau nu. Solubilitatea diferitelor substanțe Terapia de detoxifiere.
Terapia de detoxifiere. Heterogenitate echilibrată
Heterogenitate echilibrată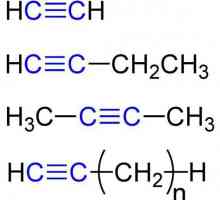 Proprietăți chimice ale alchinelor. Structura, recepția, aplicarea
Proprietăți chimice ale alchinelor. Structura, recepția, aplicarea Soluții adevărate sunt ce? Proprietăți și compoziție
Soluții adevărate sunt ce? Proprietăți și compoziție Solubilitatea este ce?
Solubilitatea este ce? Tipuri de soluții. Tipuri de concentrație a soluției
Tipuri de soluții. Tipuri de concentrație a soluției Soluții: concentrație, fracție de masă. Definiție, calcul și recomandări
Soluții: concentrație, fracție de masă. Definiție, calcul și recomandări Ce substanțe sunt numite pure: definiția conceptelor și a exemplelor
Ce substanțe sunt numite pure: definiția conceptelor și a exemplelor Factorii care determină solubilitatea proteinelor. Proprietățile fizico-chimice ale proteinelor
Factorii care determină solubilitatea proteinelor. Proprietățile fizico-chimice ale proteinelor Proprietățile și aplicarea anilinei
Proprietățile și aplicarea anilinei Faza dispersată este ceea ce?
Faza dispersată este ceea ce? Dispozitive de dispersie: caracteristici generale și clasificare
Dispozitive de dispersie: caracteristici generale și clasificare Proprietățile fizice și chimice ale metalelor
Proprietățile fizice și chimice ale metalelor Soluții coloidale - un cuvânt nou în medicină
Soluții coloidale - un cuvânt nou în medicină Sulfat de calciu. descriere
Sulfat de calciu. descriere



 Substanțe și amestecuri pure. Metode de separare a amestecurilor
Substanțe și amestecuri pure. Metode de separare a amestecurilor Biotransformarea este ceea ce?
Biotransformarea este ceea ce? Concentrația de moleculă. Care este concentrația molară și molară?
Concentrația de moleculă. Care este concentrația molară și molară? Argila în apă se dizolvă sau nu. Solubilitatea diferitelor substanțe
Argila în apă se dizolvă sau nu. Solubilitatea diferitelor substanțe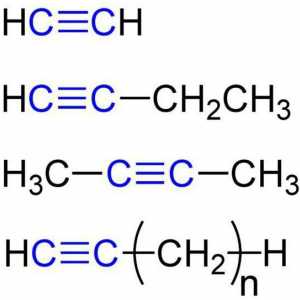 Proprietăți chimice ale alchinelor. Structura, recepția, aplicarea
Proprietăți chimice ale alchinelor. Structura, recepția, aplicarea Soluții adevărate sunt ce? Proprietăți și compoziție
Soluții adevărate sunt ce? Proprietăți și compoziție Solubilitatea este ce?
Solubilitatea este ce?