Starea agregată a materiei
Starea fizică sau agregată a materiei este caracterizată de proprietățile sale specifice în condiții specifice (presiune și temperatură). Adică, poate fi solid, lichid sau gazos. Schimbarea stărilor agregate ale unei substanțe conduce la o modificare a acesteia proprietățile fizice (densitate, entropie, energie liberă). Fiind în stare solidă, este capabil să mențină un volum și o formă fixă. După trecerea într-un lichid, cu același volum, se schimbă forma, se adaptează la recipient sau container. Fiind gazos, aceeași substanță nu reține nu numai forma, ci și volumul, deoarece, extinderea, umple întregul spațiu.
De exemplu, starea agregată de apă poate fi solidă, lichidă sau gazoasă. În acest caz, formula chimică (H2O) și compoziția moleculei (doi atomi de hidrogen și un atom de oxigen) nu se schimbă. La temperaturi de la 0 ° C și mai jos este în stare solidă și se numește gheață. De la 0 ° C până la 99,944 ° C este un lichid incolor (pentru volume mici) transparent, care nu are miros și gust. La o temperatură de 99,944 ° C trece în faza gazoasă și se numește vapori de apă. Acest exemplu arată că starea agregată a unei substanțe se modifică odată cu schimbarea condițiilor externe. În acest caz, aproape nici o presiune ambientală în schimbare, dar schimbările de temperatură, gheața se topește la temperatura de 0 ° C și se transformă în apă și care fierbe la 99.944 ° C si se evapora, se transformă în abur.
Apa, putem spune, diferă în proprietățile sale, fiind în diferite state agregate. Densitatea gheții egală cu 0,917 g / smsup3-, apă în stare lichidă în condiții standard de 0.9982 g / smsup3-, vapori de apă (de asemenea, în condiții standard) - mai puțin de 0,001 g / smsup3-. Vâscozitate dinamică apă la punctul de topire al gheții (punctul de congelare al apei) este: m = 1,793middot-103 Pamiddot-s, iar la 20 ° C vâscozitatea dinamică a apei este: mu-= 1,003middot-10-sup3-Pamiddot-s. Astfel, starea agregată a unei substanțe și proprietățile acesteia se schimbă în timpul unei tranziții de fază. Această tranziție se caracterizează printr-un punct de topire (materia solidă devine lichidă) egală cu temperatura de cristalizare (solidifică lichid) și fierbere (lichid intră gaz) egală cu temperatura de condensare (gazul devine lichid).
Trebuie subliniat faptul că starea agregată a unei substanțe depinde de compoziția acesteia. De exemplu, în aceleași condiții externe, diferite substanțe diferă în proprietățile lor. În condiții standard, apa H2O este lichidă. Hidrogenul H2 și oxigenul O2 sunt gaze. Iron Fe este un solid (al său punctul de topire 1538,9 ° C, punct de fierbere 2860,9 ° C). Dar aceeași stare agregată pentru diferite substanțe poate avea unele asemănări.
De exemplu, forțele intermoleculare relativ mici sunt caracteristice pentru gaze. Prin urmare, moleculele lor se află la o distanță mare una de cealaltă. Ca urmare, gazele pot contracta puternic. Moleculele de gaze se mișcă constant, iar mișcarea este haotică. Aceasta explică capacitatea substanțelor gazoase de a umple în mod egal întregul volum cu care sunt livrate: gazele dobândesc forma și volumul containerului în care sunt amplasate.
Lichidele dintre substanțele gazoase și cele solide ocupă o poziție intermediară. Pe masura ce temperatura creste, ele devin mai mult ca gazele, iar cu o scadere a temperaturii, ele sunt mai degraba asemanatoare solidelor. Moleculele de lichide sunt plasate mai dens, datorită forțelor de atracție apreciabile între ele. Studiile cu raze X au arătat că au unele rudimente care seamănă cu o structură cristalină.
Solidul are întotdeauna anumite forme și volume. Pentru a le schimba, este necesar să se depună eforturi, deoarece moleculele, atomii și ionii sunt strâns legați. Particulele de materie solidă nu se pot mișca liber, deoarece își păstrează aranjamentul reciproc și efectuează oscilații ordonate în jurul centrelor de echilibru. Sunt cunoscute două stări de solide - amorfe și cristaline. Cristalele din cele din urmă se caracterizează printr-o formă pentru ele. De exemplu, cristalele de clorură de sodiu NaCI se aseamănă cu forma cubului, nitrat de potasiu KNO3 - prisma și așa mai departe. Structura amorfei este moleculele aleasate aleator. spre deosebire de substanțe cristaline, care se topește la o anumită temperatură, amorf este caracterizat printr-o gamă largă de punct de topire. Uneori sunt tratate ca un lichid cu vâscozitate foarte mare. Când condițiile în care substanța solidă se schimbă, se poate obține atât în stare cristalină, cât și în stare amorfă.
Starea agregată a unei substanțe este uneori descrisă ca cristale de plasmă sau lichid. Dar aceasta nu este o definiție corectă. Întrebarea necesită un studiu separat și mai detaliat, deci în acest articol această stare de materie nu este afectată.
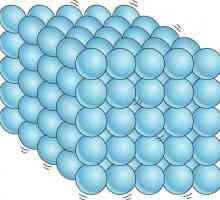 Cum sunt situate particulele în solide, lichide și gaze?
Cum sunt situate particulele în solide, lichide și gaze? Ce constă în apă: din care molecule și atomi
Ce constă în apă: din care molecule și atomi Cu ce compuși reacționează monoxidul de carbon 4? La ce substanțe reacționează dioxidul de carbon?
Cu ce compuși reacționează monoxidul de carbon 4? La ce substanțe reacționează dioxidul de carbon?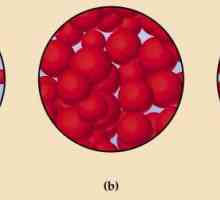 Ce este un stat agregat? Starea agregată a materiei
Ce este un stat agregat? Starea agregată a materiei Ce se numește substanță? Substanțe simple și complexe: concept
Ce se numește substanță? Substanțe simple și complexe: concept Proprietățile lichidelor. Proprietățile fizice de bază ale unui lichid
Proprietățile lichidelor. Proprietățile fizice de bază ale unui lichid Starea apei în natură. Apă în trei forme agregate
Starea apei în natură. Apă în trei forme agregate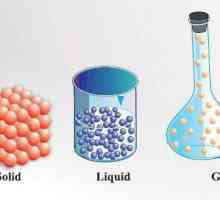 Proprietățile și structura corpurilor gazoase, lichide și solide
Proprietățile și structura corpurilor gazoase, lichide și solide Trei stări de apă: lichid, gheață și gaz
Trei stări de apă: lichid, gheață și gaz Cristalizarea și topirea: graficul modificării stării agregate a materiei
Cristalizarea și topirea: graficul modificării stării agregate a materiei Vâscozitatea apei
Vâscozitatea apei Cum se determină compoziția calitativă și cantitativă a materiei
Cum se determină compoziția calitativă și cantitativă a materiei Cum are loc trecerea unei substanțe dintr-o stare lichidă într-o stare solidă?
Cum are loc trecerea unei substanțe dintr-o stare lichidă într-o stare solidă? Lichid hidrogen: proprietăți și aplicații
Lichid hidrogen: proprietăți și aplicații Lichidul heliu: trăsături și proprietăți ale materiei
Lichidul heliu: trăsături și proprietăți ale materiei Substanțe fizice: exemple și descrieri
Substanțe fizice: exemple și descrieri Plasma (stare agregată). Creat artificial și plasma naturală
Plasma (stare agregată). Creat artificial și plasma naturală Clasificarea reacțiilor chimice
Clasificarea reacțiilor chimice Fizica moleculară
Fizica moleculară Punctul de topire - fiecare are propriile sale
Punctul de topire - fiecare are propriile sale Proprietățile gheții: structura, proprietățile mecanice și fizice ale gheții
Proprietățile gheții: structura, proprietățile mecanice și fizice ale gheții
 Ce constă în apă: din care molecule și atomi
Ce constă în apă: din care molecule și atomi Cu ce compuși reacționează monoxidul de carbon 4? La ce substanțe reacționează dioxidul de carbon?
Cu ce compuși reacționează monoxidul de carbon 4? La ce substanțe reacționează dioxidul de carbon? Ce este un stat agregat? Starea agregată a materiei
Ce este un stat agregat? Starea agregată a materiei Ce se numește substanță? Substanțe simple și complexe: concept
Ce se numește substanță? Substanțe simple și complexe: concept Proprietățile lichidelor. Proprietățile fizice de bază ale unui lichid
Proprietățile lichidelor. Proprietățile fizice de bază ale unui lichid Starea apei în natură. Apă în trei forme agregate
Starea apei în natură. Apă în trei forme agregate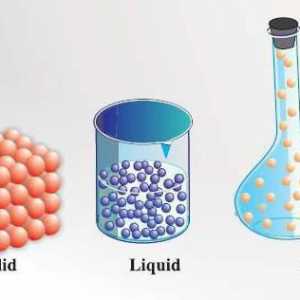 Proprietățile și structura corpurilor gazoase, lichide și solide
Proprietățile și structura corpurilor gazoase, lichide și solide Trei stări de apă: lichid, gheață și gaz
Trei stări de apă: lichid, gheață și gaz Cristalizarea și topirea: graficul modificării stării agregate a materiei
Cristalizarea și topirea: graficul modificării stării agregate a materiei