Oxid de clor
Oxizii sau oxizii sunt compuși ai diferitelor elemente cu oxigen. Aproape toate elementele formează astfel de compuși. Clorul, ca și alți halogeni, se caracterizează în astfel de compuși printr-o stare de oxidare pozitivă. Toți oxizii de clor sunt substanțe extrem de instabile, tipice pentru oxizii tuturor halogentelor. Sunt cunoscute patru substanțe, moleculele cărora conțin clor și oxigen.
- Compusul gazos de la galben la roșu cu un miros caracteristic (ca mirosul de gaz C12) este oxidul de clor (I). Formula este Cl2O chimică. Punctul de topire minus 116 ° C, punct de fierbere plus 2 ° C. În condiții normale, densitatea este de 3,22 kg / msup3-.
- Gaz galben sau galben-portocaliu cu miros caracteristic - oxid de clor (IV). Formula chimică ClO2. Punct de topire minus 59 ° C, punct de fierbere plus 11 ° C.
- Roșu-brun lichid este oxidul de clor (VI). Formula este Cl2O6 chimică. Punctul de topire este plus 3,5 ° C, punctul de fierbere plus 203 ° C.
- Lichid uleios incolor - oxid de clor (VII). Formula Chemical Cl2O7. Punctul de topire este minus 91,5 ° C, punctul de fierbere este plus 80 ° C.
Oxidul de clor cu o stare de oxidare de +1 este anhidridă a unui acid slab hipoclorhidric monociclic (HClO). Se prepara prin metoda oxidului său mercuric Peluso prin reacție cu clor gazos, în conformitate cu una dintre ecuații de reacție: 2Cl2 + 2HgO → Cl2O + Hg2OCl2 sau 2Cl2 + HgO → Cl2O + HgCl2. Condițiile acestor reacții sunt diferite. Oxidul de clor (I) este condensat la minus 60 ° C, deoarece la temperaturi mai ridicate se descompune, explodează și în formă concentrată este exploziv. O soluție apoasă de Cl20 este obținută prin clorurarea în carbonat de sodiu alcalin sau carbonați de metale alcaline. Oxidul este foarte solubil în apă și se formează acid hipocloric: Cl2O + H2O harr- 2HClO. În plus, se dizolvă, de asemenea, în tetraclorură de carbon.
Oxidul de clor cu o stare de oxidare de +4 este altfel numit dioxid. Acest material a fost dizolvat în apă, acid sulfuric și acid acetic, acetonitril, tetraclorură de carbon, și alți solvenți organici cu polaritate crescătoare care crește solubilitatea. În laborator se obține prin interacțiune clorat de potasiu cu acid oxalic: 2KClO3 + H2C2O4 → K2CO3 + 2ClO2 + CO2 + H2O. Deoarece oxidul de clor (IV) este o substanță explozivă, acesta nu poate fi depozitat în soluție. În acest scop, se utilizează silice, pe a cărui suprafață în formă adsorbită ClO2 pot fi stocate pentru o lungă perioadă de timp, în timp ce în imposibilitatea de a scăpa de contaminare impuritățile de clor, deoarece nu este absorbită de gel de silice. În condiții industriale ClO2 preparate prin reducerea cu bioxid de sulf, în prezența acidului sulfuric, clorat de sodiu: 2NaClO3 + SO2 + H2SO4 → 2NaHSO4 + 2ClO2. Se utilizează ca un înălbitor, de exemplu, hârtie sau celuloză etc., precum și pentru sterilizarea și dezinfectarea diferitelor materiale.
Oxidul de clor cu o stare de oxidare de +6, se descompune la topire prin ecuația de reacție: Cl2O6 → 2ClO3. Oxidul de clor (VI) se obține prin oxidarea cu dioxid de ozon: 2O3 + 2ClO2 → 2O2 + Cl2O6. Acest oxid este capabil să reacționeze cu soluții de alcalii și cu apă. Există reacții de disproporție. De exemplu, atunci când reacționează cu hidroxid de potasiu: 2KOH + Cl2O6 → KCI03 + KCI04 + H20, se obține cloratul și percloratul de potasiu.
Oxid de mare clorul este denumit și anhidrida clorului sau diclorheptaoxidul este un oxidant puternic. Este capabil să explodeze sau să se încălzească. Cu toate acestea, această substanță este mai stabilă decât oxizii cu o stare de oxidare de +1 și +4. Descompunerea sa la clor și oxigen este accelerată datorită prezenței oxizilor inferiori și cu o creștere a temperaturii de la 60 la 70 ° C. Oxidul de clor (VII) este capabil să se dizolve încet în apă rece, ducând la o reacție acid percloric: H2O + Cl207 → 2HCI04. Diclorheptoxidul este preparat prin încălzirea ușoară a acidului percloric cu anhidrida fosforică: P4O10 + 2HClO4 → Cl2O7 + H2P4O11. De asemenea, Cl2O7 poate fi obținut folosind oleum în loc de anhidridă fosforică.
Secțiunea de chimie anorganică care studiază oxizii de halogen, inclusiv oxizii de clor, se dezvoltă în mod activ în ultimii ani, deoarece acești compuși sunt energo-intensivi. Sunt capabile de camere de combustie motoarele cu jet da energie instantaneu, și în surse chimice de curent rata reculului poate fi reglată. Un alt motiv de interes este posibilitatea de a sintetiza noi grupe de compuși anorganici, de exemplu, oxidul de clor (VII) este strămoșul percloratilor.
 Conexiunile binare sunt ce?
Conexiunile binare sunt ce? Care îngrășăminte de potasiu pentru tomate sunt optime?
Care îngrășăminte de potasiu pentru tomate sunt optime?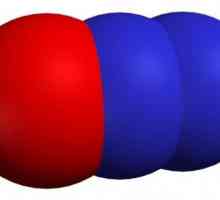 Oxidul de azot (I, II, III, IV, V): proprietăți, producție, aplicare
Oxidul de azot (I, II, III, IV, V): proprietăți, producție, aplicare Oxid de magneziu: proprietăți, producție, aplicare
Oxid de magneziu: proprietăți, producție, aplicare Formula de sare este gătit. Formulă chimică: sare de masă. Proprietățile sarei de masă
Formula de sare este gătit. Formulă chimică: sare de masă. Proprietățile sarei de masă Clorura ferică
Clorura ferică Oxid de hidrogen: obținere și proprietăți
Oxid de hidrogen: obținere și proprietăți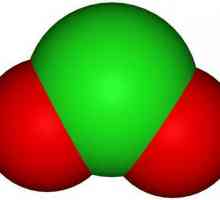 Dioxidul de clor: formula, aplicare. Efectele dioxidului de clor asupra corpului
Dioxidul de clor: formula, aplicare. Efectele dioxidului de clor asupra corpului Chimie: oxizi, clasificarea și proprietățile lor
Chimie: oxizi, clasificarea și proprietățile lor Care este natura oxizilor
Care este natura oxizilor Oxid de tungsten mai mare
Oxid de tungsten mai mare Oxid de sulf
Oxid de sulf Metale alcaline
Metale alcaline Oxidul de crom
Oxidul de crom Acid oxizi: o scurtă descriere a grupului
Acid oxizi: o scurtă descriere a grupului Oxizi amfoterici. Proprietăți chimice, metoda de producție
Oxizi amfoterici. Proprietăți chimice, metoda de producție Ce este o legătură de hidrogen? Tipuri, influență
Ce este o legătură de hidrogen? Tipuri, influență Oxid de calciu. Proprietăți fizice, termice și chimice. Aplicație.
Oxid de calciu. Proprietăți fizice, termice și chimice. Aplicație. Oxizi de bază și proprietățile acestora
Oxizi de bază și proprietățile acestora Acid azotic. Proprietăți chimice și fizice
Acid azotic. Proprietăți chimice și fizice Oxizii. Exemple, clasificare, proprietăți
Oxizii. Exemple, clasificare, proprietăți
 Care îngrășăminte de potasiu pentru tomate sunt optime?
Care îngrășăminte de potasiu pentru tomate sunt optime? Oxidul de azot (I, II, III, IV, V): proprietăți, producție, aplicare
Oxidul de azot (I, II, III, IV, V): proprietăți, producție, aplicare Oxid de magneziu: proprietăți, producție, aplicare
Oxid de magneziu: proprietăți, producție, aplicare Formula de sare este gătit. Formulă chimică: sare de masă. Proprietățile sarei de masă
Formula de sare este gătit. Formulă chimică: sare de masă. Proprietățile sarei de masă Oxid de hidrogen: obținere și proprietăți
Oxid de hidrogen: obținere și proprietăți Dioxidul de clor: formula, aplicare. Efectele dioxidului de clor asupra corpului
Dioxidul de clor: formula, aplicare. Efectele dioxidului de clor asupra corpului Chimie: oxizi, clasificarea și proprietățile lor
Chimie: oxizi, clasificarea și proprietățile lor Care este natura oxizilor
Care este natura oxizilor Oxid de tungsten mai mare
Oxid de tungsten mai mare