Nitrarea toluenului: ecuația de reacție
Să vorbim despre modul în care este efectuată nitrarea toluenului. Obțineți o interacțiune similară a unui număr imens de produse semifinite utilizate în fabricarea explozivilor, produselor farmaceutice.
conținut
Importanța nitrării
Derivații de benzen sub formă de nitro-compuși aromatici sunt produși în industria chimică modernă. Nitrobenzenul este un produs semifinit în anilină, parfum, producție farmaceutică. Este un solvent excelent pentru mulți compuși organici, incluzând nitritul de celuloză, formând o masă gelatinoasă cu acesta. În industria petrolieră se utilizează ca un produs de curățare pentru uleiurile lubrifiante. Nitrarea toluenului conduce la benzidină, anilină, acid aminosalicilic, fenilendiamină.

Caracterizarea nitrației
Nitrarea este caracterizată prin introducerea grupării NO2 în moleculă a compusului organic. În funcție de materia primă, acest proces are loc printr-un mecanism radical, nucleofil, electrofil. Cationii de azot, ionii și radicalii de NO2 acționează ca particule active. Reacția de nitrare a toluenului se referă la substituție. Pentru alte substanțe organice, este posibilă nitrarea substituției, precum și atașarea dublă a legăturii.
Nitrarea toluenului în molecula de hidrocarbură aromatică se realizează utilizând un amestec de nitrare (acizi sulfurici și azotați). Proprietățile catalitice sunt demonstrate de acidul sulfuric, care acționează ca agent de absorbție a apei în acest proces.

Ecuația procesului
Nitrarea toluenului implică înlocuirea unui atom de hidrogen cu o grupare nitro. Cum arată schema procesului de procedură?
Pentru a descrie nitrarea toluenului, ecuația de reacție poate fi reprezentată în următoarea formă:
ArH + HONO2 + = Ar-N02 + H20
Ne permite să judecăm numai cursul general de interacțiune, dar nu dezvăluie toate trăsăturile acestui proces. De fapt, există o reacție între hidrocarburile aromatice și produsele cu acid azotic.
Având în vedere că în produse există molecule de apă, aceasta duce la o scădere a concentrației de acid azotic, astfel încât nitrarea toluenului încetinește. Pentru a evita o astfel de problemă, acest proces se desfășoară la temperaturi scăzute, folosind acid azotic în exces.
În plus față de acidul sulfuric, sunt utilizați agenți de deshidratare anhidridă acetică, acizi polifosforici, trifluorură de bor. Acestea fac posibilă reducerea consumului de acid azotic, creșterea eficacității interacțiunii.

Nuanțele procesului
Nitrarea toluenului a fost descrisă la sfârșitul secolului al XIX-lea de V. Markovnikov. A reușit să stabilească o legătură între prezența în amestecul de reacție acid sulfuric concentrat și viteza procesului. În producția modernă de nitrotoluen se utilizează acid azotic anhidru, luat în exces.
În plus, sulfonarea și nitrarea toluenului sunt asociate cu utilizarea unei componente disponibile pentru îndepărtarea apei de fluorură de bor. Introducerea sa în procesul de reacție face posibilă reducerea costului produsului obținut, ceea ce face disponibilă nitrarea toluenului. Ecuația procesului de procedură în formă generală este prezentată mai jos:
ArH + HN03 + BF3 = Ar-N02 + BF3 middot-H20
După terminarea reacției, se introduce apă, prin care monohidratul de fluorură de bor formează un dihidrat. Se îndepărtează prin distilare în vid, apoi se adaugă fluorură de calciu, rezultând compusul în forma sa originală.

Specificitatea nitrării
Există câteva trăsături ale acestui proces asociate cu alegerea reactivilor, substratului de reacție. Să luăm în considerare câteva variante ale acestora:
- 60-65% acid azotic într-un amestec cu 96% acid sulfuric;
- un amestec de acid azotic 98% și acid sulfuric concentrat este adecvat pentru substanțele organice cu reacție redusă;
- Azotatul de potasiu sau de amoniu cu acid sulfuric concentrat este o alegere excelentă pentru producerea compușilor nitro-polimerici.

Nitrația cinetică
Hidrocarburi aromatice, interacționând cu un amestec de acizi sulfurici și azotați, sunt nitrați de mecanismul ionic. V. Marknovnikov a reușit să caracterizeze specificul acestei interacțiuni. Procesul are loc în mai multe etape. Mai întâi se formează acid azotic, care este disociat într-o soluție apoasă. Nitroniu ionii interacționează cu toluen, formând nitrotoluen ca produs. Atunci când moleculele de apă sunt adăugate la amestec, procesul încetinește.
În solvenții cu natură organică - nitrometan, acetonitril, sulfolan - formarea acestui cation permite o creștere a ratei de nitrare.
Cationul nitroniu rezultat este atașat la miezul toluenului aromatic, se formează un compus intermediar. Mai mult, un proton este detașat, ceea ce duce la formarea de nitrotoluen.
Pentru o descriere detaliată a procesului în desfășurare, se poate lua în considerare formarea complexelor "sigma" și "pi". Formarea complexului "sigma" este stadiul limitator al interacțiunii. Viteza de răspuns va fi direct legată de viteza de adăugare a cationului de nitroniu la atomul de carbon din miezul compusului aromatic. Desprinderea protonului din toluen este aproape instantanee.
Numai în anumite situații, pot exista unele probleme de înlocuire asociate cu un efect izotopic cinetic primar semnificativ. Acest lucru se datorează accelerației procesului invers în prezența unor obstacole de diferite tipuri.
Când se selectează acidul sulfuric concentrat ca catalizator și agent de îndepărtare a apei, se observă o schimbare în echilibrul procesului către formarea de produse de reacție.

concluzie
Nitrarea toluenului produce nitrotoluen, care este un produs valoros al industriei chimice. Această substanță este un compus exploziv, așa că este revendicat în operațiunile de pușcare. Dintre problemele de mediu asociate cu producția sa industrială, observăm utilizarea unei cantități semnificative de acid sulfuric concentrat.
Pentru a face față acestei probleme, chimiștii caută modalități de reducere a deșeurilor de acid sulfuric produse după procesul de nitrare. De exemplu, procesul se desfășoară la temperaturi scăzute, folosind medii ușor regenerabile. Acidul sulfuric are proprietăți puternice de oxidare, care afectează în mod negativ coroziunea metalelor, prezintă un pericol crescut pentru organismele vii. Dacă se respectă toate standardele de siguranță, este posibil să se facă față acestor probleme, pentru a obține compuși nitro de înaltă calitate.
 Solvenți organici: descriere, clasificare, tipuri și caracteristici de utilizare
Solvenți organici: descriere, clasificare, tipuri și caracteristici de utilizare Formula de toluen: ce este toluenul și cum se obține?
Formula de toluen: ce este toluenul și cum se obține? Organic materia caracteristicile și clasificarea lor
Organic materia caracteristicile și clasificarea lor Reacții calitative la fenol. Prepararea fenolilor: reacții
Reacții calitative la fenol. Prepararea fenolilor: reacții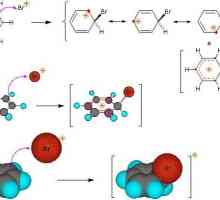 Reacțiile de substituție: descriere, ecuație, exemple
Reacțiile de substituție: descriere, ecuație, exemple Prepararea benzenului
Prepararea benzenului Care alcani sunt caracterizați prin reacții
Care alcani sunt caracterizați prin reacții Aminele sunt ... Structura, proprietățile, clasele de amine
Aminele sunt ... Structura, proprietățile, clasele de amine Benzenul este ... Formula structurală, proprietățile și producția de benzen
Benzenul este ... Formula structurală, proprietățile și producția de benzen Sunt hidrocarburile alifatice?
Sunt hidrocarburile alifatice? Ce este benzenul? Structura benzenului, formula, proprietățile, aplicația
Ce este benzenul? Structura benzenului, formula, proprietățile, aplicația Proprietățile și aplicarea anilinei
Proprietățile și aplicarea anilinei Compuși organici și clasificarea acestora
Compuși organici și clasificarea acestora Nomenclatorul compușilor organici
Nomenclatorul compușilor organici Acid benzoic
Acid benzoic Seria de omologie
Seria de omologie Eteri. trăsătură
Eteri. trăsătură Alcool benzilic: proprietăți, producție, aplicare
Alcool benzilic: proprietăți, producție, aplicare Utilizarea alcanilor
Utilizarea alcanilor Esteri: proprietăți chimice și aplicații
Esteri: proprietăți chimice și aplicații Producția de alcani și proprietățile acestora
Producția de alcani și proprietățile acestora
 Formula de toluen: ce este toluenul și cum se obține?
Formula de toluen: ce este toluenul și cum se obține? Reacții calitative la fenol. Prepararea fenolilor: reacții
Reacții calitative la fenol. Prepararea fenolilor: reacții Reacțiile de substituție: descriere, ecuație, exemple
Reacțiile de substituție: descriere, ecuație, exemple Care alcani sunt caracterizați prin reacții
Care alcani sunt caracterizați prin reacții Aminele sunt ... Structura, proprietățile, clasele de amine
Aminele sunt ... Structura, proprietățile, clasele de amine Benzenul este ... Formula structurală, proprietățile și producția de benzen
Benzenul este ... Formula structurală, proprietățile și producția de benzen Sunt hidrocarburile alifatice?
Sunt hidrocarburile alifatice? Ce este benzenul? Structura benzenului, formula, proprietățile, aplicația
Ce este benzenul? Structura benzenului, formula, proprietățile, aplicația