Centrul activ al enzimei: structura, proprietățile. Cine a descoperit centrul activ al enzimei? Ce se numește centrul activ al enzimei?
Am auzit cu toții despre enzime, dar este puțin probabil să știm cu toții cum sunt aranjate aceste substanțe și de ce sunt necesare. Acest articol vă va ajuta să înțelegeți structura și funcțiile enzime (enzime)
conținut
Istoria cercetării
În 1833, chimistul francez Anselm Payen a descoperit și a descris proprietățile enzimei amilase.
Câțiva ani mai târziu, Louis Pasteur, studiind conversia zahărului în alcool cu participarea drojdiei, a sugerat că acest proces se datorează substanțelor chimice care alcătuiesc drojdia.
La sfârșitul secolului al XIX-lea, fiziologul Willie Kühne a introdus pentru prima dată termenul "enzimă".
Germanul Eduard Buchner, în 1897, a evidențiat și descrie zymase-ul, un complex enzimatic care catalizează reacția conversiei zaharozei în alcoolul etilic. În natură, zymase este abundent în drojdie.
Nu se știe exact când și cine a descoperit centrul activ al enzimei. Această descoperire este atribuită chemistratorului câștigător al Premiului Nobel, Eduard Buchner, biologului american James Sumner și altor cunoscuți oameni de știință care lucrează la studiul catalizei enzimatice.

Informații generale privind enzimele
Reamintim că enzimele sunt substanțe de natură proteică care se comportă în organismele vii ca și catalizatori ai reacțiilor chimice. În enzimă există zone care nu participă în mod direct la aceasta, cursul reacției asigură centrul activ al enzimei.
Oferim câteva proprietăți ale enzimelor:
1) Eficiența. O cantitate mică de catalizator este suficientă pentru a accelera reacția chimică la 10 ° C6 timp.

2) Specificitatea. O enzimă nu este un catalizator universal pentru orice reacție din celulă. Pentru enzime, se exprimă specificitatea acțiunii: fiecare enzimă catalizează numai una sau mai multe reacții cu substraturi similare (reactivi inițiali), dar pentru reactivi de natură chimică diferită, aceeași enzimă poate fi inutilă. Interacțiunea cu substraturile adecvate și accelerarea în continuare a reacției asigură centrul activ al enzimei.

3) Activitate variabilă. Activitatea enzimelor din celulă este în continuă schimbare de la scăzut la înalt.
4) Concentrația anumitor enzime în celulă nu este constantă și poate varia în funcție de condițiile externe. Astfel de enzime din biologie se numesc inductibile.
Clasificarea enzimelor
Prin structura sa, este comună împărțirea enzimelor la cele simple și complexe. Simplu constă exclusiv din reziduuri de aminoacizi, substanțele complexe au un grup non-proteic. Complexul se numește coenzime.
În funcție de tipul reacțiilor catalizate, enzimele sunt împărțite în:
1) Oxidoreductazele (catalizează reacțiile redox).
2) Transferase (transporta grupuri separate de atomi).
3) Legături (legături chimice de scindare).
4) Lipaze (formează legături în reacțiile datorate energiei ATP).
5) Izomerazele (sunt implicate în reacțiile de conversie reciprocă a izomerilor).
6) Hidlaze (catalizează reacțiile chimice cu scindarea legăturii hidrolitice).

Structura enzimei
Enzima este o structură complexă tridimensională, care constă în principal din reziduuri de aminoacizi. Există, de asemenea, un grup protetic - o componentă de natură neproteică asociată cu resturile de aminoacizi.
Enzimele sunt, în principiu, proteine globulare, care pot fi combinate în complexe complexe. Ca și alte substanțe de natură proteică, enzimele sunt denaturate atunci când temperatura crește sau sub influența anumitor reactivi chimici. În timpul denaturării, structura terțiară a enzimei se modifică și, în consecință, proprietățile centrului activ al enzimelor. Ca urmare, activitatea enzimei scade brusc.
Substratul catalizat este de obicei mult mai mic decât enzima în sine. Cea mai simplă enzimă constă din șaizeci de reziduuri de aminoacizi, iar centrul său activ este doar două.
Există enzime, ale căror situs catalitic nu este reprezentat de aminoacizi, ci un grup protetic de origine organică sau (mai des) anorganică - cofactor.
Conceptul de centru activ
Numai o mică parte a enzimei joacă un rol direct în reacțiile chimice. Această parte a enzimei este numită centrul activ. Centrul activ al enzimei este o lipidă, mai multe resturi de aminoacizi sau o grupare protetică care se leagă de substrat și catalizează reacția. Reziduurile de aminoacid ale situsului activ pot aparține oricăror aminoacizi - polari, nepolari, încărcați, aromatici, neîncărcați.
Centrul activ al enzimei (este o lipidă, aminoacizi sau alte substanțe capabile să interacționeze cu reactivi) este cea mai importantă parte a enzimei, fără aceasta, aceste substanțe ar fi inutile.
În mod tipic, molecula enzimei are numai un situs activ care se leagă la unul sau mai mulți reactivi similari. Reziduurile de aminoacizi ale sitului activ formează legături hidrogen, hidrofobe sau covalente, formând un complex enzimă-substrat.
Structura centrului activ
Centrul activ al enzimelor simple și complexe este un buzunar sau o fantă. Această structură a centrului activ al enzimei trebuie să corespundă electrostatic și geometric substratului, deoarece o modificare a structurii terțiare a enzimei poate modifica situsul activ.
Centrul de legare și catalitice sunt zonele din centrul activ al enzimei. Evident, centrul de legare "verifică" compatibilitatea substratului și comunică cu acesta, iar centrul catalitic are un rol direct în reacție.
Legarea centrului activ la substrat
Pentru a explica modul în care centrul activ al enzimei se leagă de un anumit reactiv, s-au propus mai multe teorii. Cea mai populară dintre ele este teoria lui Fisher, este, de asemenea, teoria "încuietorii și cheii". Fischer a sugerat că există o enzimă, potrivită ideal pentru fiecare substrat în proprietățile sale fizico-chimice. După formarea complexului enzimă-substrat, nu are loc nicio modificare.

Un alt om de știință american, Daniel Koschland, a completat teoria lui Fisher cu presupunerea că centrul activ al unei enzime își poate schimba conformația până când ajunge la un anumit substrat.
Kinetica reacțiilor enzimatice
Caracteristicile cursului de reacții enzimatice sunt studiate de o ramură separată a biochimiei - cinetica enzimatică. Această știință studiază caracteristicile cursului de reacții la diferite concentrații de enzime și substraturi, dependența ratei de reacție la temperatură în interiorul celulei, precum și proprietățile centrului activ al enzimelor, în funcție de modificările parametrilor fizici și chimici ai mediului.

Cinetica enzimatică operează cu astfel de concepte ca rata de reacție, energia de activare, bariera de activare, activitatea moleculară, activitatea specifică etc. Să analizăm unele dintre aceste concepte.
Pentru a avea o reacție biologică, reactivii trebuie să transfere o anumită energie. Această energie se numește energia de activare.
Adăugarea enzimei la reactivi poate reduce energia de activare. Unele substanțe reacționează fără participarea enzimelor, deoarece energia de activare este prea mare. Echilibrul reacției nu se schimbă odată cu adăugarea enzimei.
Rata de reacție este cantitatea de produs de reacție care apare sau dispare pe unitatea de timp.
Dependența ratei de reacție de concentrația substratului este caracterizată de o cantitate fizică fără dimensiuni, de constanta Michaelis.
Activitatea moleculară - numărul de molecule ale substratului, transformat de o singură moleculă a enzimei pe unitate de timp.
 Enzima lactază este un element vital pentru creștere și dezvoltare
Enzima lactază este un element vital pentru creștere și dezvoltare Enzima de catalază: caracteristici de bază
Enzima de catalază: caracteristici de bază Enzima este un catalizator pentru procesele biochimice din organism
Enzima este un catalizator pentru procesele biochimice din organism Rennet enzime - proprietăți și aplicare. Ce influență are asupra corpului uman?
Rennet enzime - proprietăți și aplicare. Ce influență are asupra corpului uman? Fenilcetonuria - ce este și cum să trăim cu ea
Fenilcetonuria - ce este și cum să trăim cu ea Care este funcția enzimatică a proteinelor? Funcția enzimatică a proteinelor: exemple
Care este funcția enzimatică a proteinelor? Funcția enzimatică a proteinelor: exemple Funcția enzimelor. Rolul enzimelor în organism
Funcția enzimelor. Rolul enzimelor în organism Alanin aminotransferaza este crescută - un semn al proceselor inflamatorii și distrofice în organe
Alanin aminotransferaza este crescută - un semn al proceselor inflamatorii și distrofice în organe Ce sunt lizozomii: structura, compoziția și funcțiile lizozomilor
Ce sunt lizozomii: structura, compoziția și funcțiile lizozomilor Biochimia enzimelor. Structura, proprietățile și funcțiile
Biochimia enzimelor. Structura, proprietățile și funcțiile Proteina-enzimă: rolul, proprietățile, funcția proteinelor-enzimelor din organism
Proteina-enzimă: rolul, proprietățile, funcția proteinelor-enzimelor din organism Reglarea activității enzimei și a metodelor sale
Reglarea activității enzimei și a metodelor sale Specificitatea enzimei: tipuri și trăsături ale acțiunii
Specificitatea enzimei: tipuri și trăsături ale acțiunii Totul despre enzima pepsină
Totul despre enzima pepsină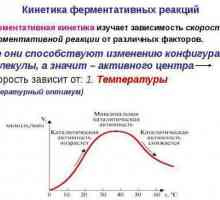 Kinetica reacțiilor enzimatice - descriere, caracteristici și tabel
Kinetica reacțiilor enzimatice - descriere, caracteristici și tabel Aplicarea enzimelor în medicină
Aplicarea enzimelor în medicină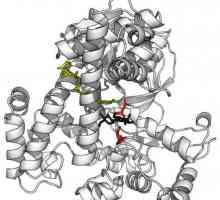 Coenzimele sunt molecule mici de natură non-proteică. Structura și aplicarea coenzimelor
Coenzimele sunt molecule mici de natură non-proteică. Structura și aplicarea coenzimelor Ce sunt enzimele?
Ce sunt enzimele? Fermentarea alcoolică
Fermentarea alcoolică Ciclul Krebs - principalele etape și semnificația pentru sistemele biologice
Ciclul Krebs - principalele etape și semnificația pentru sistemele biologice Mecanism de acțiune al enzimelor
Mecanism de acțiune al enzimelor
 Enzima de catalază: caracteristici de bază
Enzima de catalază: caracteristici de bază Enzima este un catalizator pentru procesele biochimice din organism
Enzima este un catalizator pentru procesele biochimice din organism Rennet enzime - proprietăți și aplicare. Ce influență are asupra corpului uman?
Rennet enzime - proprietăți și aplicare. Ce influență are asupra corpului uman? Fenilcetonuria - ce este și cum să trăim cu ea
Fenilcetonuria - ce este și cum să trăim cu ea Care este funcția enzimatică a proteinelor? Funcția enzimatică a proteinelor: exemple
Care este funcția enzimatică a proteinelor? Funcția enzimatică a proteinelor: exemple Funcția enzimelor. Rolul enzimelor în organism
Funcția enzimelor. Rolul enzimelor în organism Ce sunt lizozomii: structura, compoziția și funcțiile lizozomilor
Ce sunt lizozomii: structura, compoziția și funcțiile lizozomilor Biochimia enzimelor. Structura, proprietățile și funcțiile
Biochimia enzimelor. Structura, proprietățile și funcțiile Proteina-enzimă: rolul, proprietățile, funcția proteinelor-enzimelor din organism
Proteina-enzimă: rolul, proprietățile, funcția proteinelor-enzimelor din organism