Ciclul oxigenului în natură
Este recunoscut oficial că în 1774 un chimist englez Joseph Priestley oxigenul a fost descoperit (O2). Ca rezultat al experimentelor efectuate într-un vas închis cu oxid de mercur, sub influența luminii solare cristalinului îndreptate a fost expansiunea: 2HgO → O2uarr- + 2HG. Acest material gazos este caracterizat printr-o densitate în condiții normale 0.00142897 g / smsup3-, volum molar de 14,0 smsup3- / mol, o temperatură de topire de minus 218,2 ° C și temperatura de fierbere minus 182,81 ° C Masa molară este de 15,9994 g / mol. Caracteristica principală a oxigenului este capacitatea acestuia de a oxida diferite substanțe. Ca un nemetal activ, O2 reacționează cu toate metalele cu formarea de oxizi de bază și amfoteri, precum și toate nemetalelor (altele decât halogen) pentru a se obține oxizii acizi sau nesoleobrazuyuschie.
Oxigenul face parte din mai mult de o jumătate de mie de substanțe, deoarece este cel mai comun element chimic de pe Pământ. Este o componentă a mai multor compuși chimici (există mai mult de o mie și jumătate). În crusta solidă, conținutul de O2 este de 47,4%. În marin și ape dulci pe ponderea sa în condiția conectată este necesar 88,8% din masă. În atmosferă, oxigenul este în stare liberă, fracția de volum este de aproximativ 21%, iar fracțiunea de masă este de 23,1%. Este cel mai important constituent de substanțe organice prezente în fiecare celulă vie. Volumul în ele ocupă 25%, iar în greutate 65%. Ciclul de oxigen în natură se datorează activității sale chimice.
Ciclul este o serie de modificări de fond, în urma căruia se întoarce la punctul de plecare, și repetă întreaga cale. Ciclul de oxigen este o mișcare biogeochimică. Prin ea trece prin O2 suma biotice tuturor ecosistemelor (biosfera, sau o zonă a vieții pe Pământ) și abiotici (litosfera, atmosfera și hidrosfera) mediu. Ciclul oxigenului descrie mișcarea sa în hidrosfera (masa de apă situată sub pământ și deasupra suprafeței), atmosfera (aerul) din biosferă (suma globală a tuturor ecosistemelor) și lithosphere (crustă). Încălcarea acestui ciclu în hidrosfera poate duce la hipoxice (O2 scăzut), în zonele de lacuri mari și ocean. Factorul de conducere principal este fotosintezei.
Sistemele ecologice (ecosistemele) au în compoziție multe cicluri biogeochimice. De exemplu, ciclul de apă, circulația oxigenului, ciclul de azot, carbon, etc. Toate elementele chimice trec calea, care face parte din ciclurile biogeochimice. Acestea sunt o parte integrantă a organismelor vii, dar, de asemenea, deplasa prin ecosisteme mediul abiotic. Această apă (hidrosferă), crusta pământului (litosferă) și aerul (atmosfera). Organismele vii umple cochilia Pamantului, numita biosfera. Toți nutrienți, cum ar fi carbon, azot, oxigen, fosfor și sulf, acestea sunt utilizate și fac parte dintr-un sistem închis, astfel încât acestea sunt reciclate și nu a pierdut și alimentată în mod continuu, cum ar fi într-un sistem deschis.
Cel mai mare rezervor de O2 (99,5%) este cortexul și manta de pe Pamant, unde este conținut în minerale de silicat și de oxid. ciclu de pătrundere a oxigenului furnizat doar o mică parte sub formă de O2 liber în biosferă (0,01%) și atmosfera (0,36%). Principala sursă de O2 fără atmosferă este fotosinteza. Produsele acestora sunt substanțe organice și oxigenul liber format din bioxid de carbon și apă 6CO2 + 6H2O + energie → C6H12O6 + 6O2.
Plantele terestre, precum și fitoplanctonul oceanelor, răspund la ciclul oxigenului din biosferă. Micile cianobacterii marine (alge albastre-verzi) Prochlorococcus, de 0,6 microni, au fost descoperite în 1986. Acestea reprezintă mai mult de jumătate din produsele fotosintezei în oceanul deschis. O sursă suplimentară de oxigen atmosferic liber este fenomenul de fotoliză (o reacție chimică care se desfășoară sub acțiunea fotonilor). Ca urmare, apa și apa atmosferică oxidul de azot disociat în atomii constituenți, hidrogen (H) și azot (N) spațiu sunt îndepărtate, și O2 în atmosferă este: 2H2O + energie → 4H + O2 și 2N2O + energie → 4N + O2. Oxigenul liber din atmosferă este consumat de organismele vii în procesele de respirație și degradare. Litosfera folosește O2 liber ca urmare a intemperiilor chimice și a reacțiilor de suprafață. De exemplu, este cheltuit pentru educație oxizi de fier (rugină): 4FeO + O2 → 2Fe2O3 sau oxizi ai altor metale și nemetale.
Ciclul de oxigen include de asemenea un ciclu între biosferă și litosferă. Organismele marine din biosferă servesc ca surse carbonat de calciu (CaCO3), care este bogat în O2. Atunci când corpul moare, cochilia se depune pentru fundul mării de mică adâncime în cazul în care există o lungă perioadă de timp pentru a forma calcar (sedimente crustă). Procesele de intemperii, inițiate de biosferă, pot extrage oxigen liber din litosferă. Plantele și animalele extrag nutrienți din rocile sedimentare și eliberează oxigen.
 Modificări alotropice ale oxigenului: caracteristică și valoare comparativă
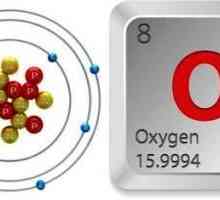
Modificări alotropice ale oxigenului: caracteristică și valoare comparativă Masa moleculară a oxigenului. Care este masa molară de oxigen?
Masa moleculară a oxigenului. Care este masa molară de oxigen?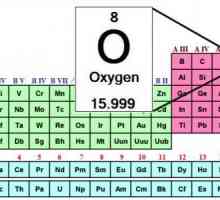 Formula de oxigen. Tabelul periodic al lui Mendeleev - oxigen
Formula de oxigen. Tabelul periodic al lui Mendeleev - oxigen Ozonul (element chimic): proprietăți, formulă, desemnare
Ozonul (element chimic): proprietăți, formulă, desemnare Care este gradul de oxidare a oxigenului? Valence și gradul de oxidare a oxigenului
Care este gradul de oxidare a oxigenului? Valence și gradul de oxidare a oxigenului Chimie: oxizi, clasificarea și proprietățile lor
Chimie: oxizi, clasificarea și proprietățile lor Este vorba despre azot? Tipuri și proprietăți ale azotului
Este vorba despre azot? Tipuri și proprietăți ale azotului Ce este oxigenul? Compuși de oxigen
Ce este oxigenul? Compuși de oxigen Care este natura oxizilor
Care este natura oxizilor Găsirea oxigenului în natură. Ciclul oxigenului în natură
Găsirea oxigenului în natură. Ciclul oxigenului în natură Oxid de clor
Oxid de clor Oxid de sulf
Oxid de sulf Dioxid de azot
Dioxid de azot Starea agregată a materiei
Starea agregată a materiei Oxid de sodiu
Oxid de sodiu Oxidul de crom
Oxidul de crom Proprietățile chimice și fizice, aplicarea și producerea oxigenului
Proprietățile chimice și fizice, aplicarea și producerea oxigenului Acid oxizi: o scurtă descriere a grupului
Acid oxizi: o scurtă descriere a grupului Oxizi amfoterici. Proprietăți chimice, metoda de producție
Oxizi amfoterici. Proprietăți chimice, metoda de producție Oxid de calciu. Proprietăți fizice, termice și chimice. Aplicație.
Oxid de calciu. Proprietăți fizice, termice și chimice. Aplicație. Oxizi de bază și proprietățile acestora
Oxizi de bază și proprietățile acestora
 Masa moleculară a oxigenului. Care este masa molară de oxigen?
Masa moleculară a oxigenului. Care este masa molară de oxigen?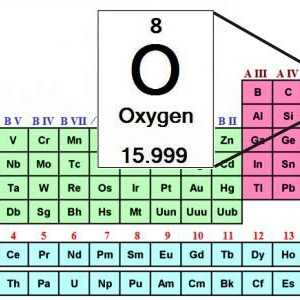 Formula de oxigen. Tabelul periodic al lui Mendeleev - oxigen
Formula de oxigen. Tabelul periodic al lui Mendeleev - oxigen Ozonul (element chimic): proprietăți, formulă, desemnare
Ozonul (element chimic): proprietăți, formulă, desemnare Care este gradul de oxidare a oxigenului? Valence și gradul de oxidare a oxigenului
Care este gradul de oxidare a oxigenului? Valence și gradul de oxidare a oxigenului Chimie: oxizi, clasificarea și proprietățile lor
Chimie: oxizi, clasificarea și proprietățile lor Este vorba despre azot? Tipuri și proprietăți ale azotului
Este vorba despre azot? Tipuri și proprietăți ale azotului Ce este oxigenul? Compuși de oxigen
Ce este oxigenul? Compuși de oxigen Care este natura oxizilor
Care este natura oxizilor Găsirea oxigenului în natură. Ciclul oxigenului în natură
Găsirea oxigenului în natură. Ciclul oxigenului în natură