Legea constanței compoziției materiei. Legi de conservare în chimie
Chimia aparține categoriei științelor exacte și, împreună cu matematica și fizica, stabilește legile existenței și dezvoltării materiei, constând din atomi și molecule. Toate procesele care apar atât în organismele vii, cât și în obiectele de natură neînsuflețită se bazează pe fenomenul transformării masei și energiei. Legea constanței compoziției
conținut

Atomic-moleculare de predare
Pentru a înțelege esența legilor care guvernează realitatea materială, trebuie să avem o idee despre ce constă. Potrivit marelui om de știință rus MV Lomonosov „în întuneric trebuie să respecte fizică și, în special, chimiști, nu cunoaște structura internă a particulelor.“ El a fost cel care, în 1741, la început, teoretic, a confirmat mai târziu, de experiență, a descoperit legile chimiei, sunt baza pentru studiul de viață și a materiei nonliving, și anume: Toate substanțele sunt compuse din atomi, molecule capabile să formeze. Toate aceste particule sunt în mișcare continuă.

Descoperiri și erori ale lui J. Dalton
După 50 de ani, ideea lui Lomonosov a fost dezvoltată de către cercetătorul englez J. Dalton. Cercetătorul a efectuat calculele cele mai importante pentru a determina masele atomice ale elementelor chimice. Aceasta a fost principala dovadă a unor astfel de ipoteze: masa moleculei și a materiei poate fi calculată, cunoscând greutatea atomică a particulelor care compun compoziția sa. Atât Lomonosov, cât și Dalton au crezut că, indiferent de metoda de producție, molecula compusului va avea întotdeauna o compoziție cantitativă și calitativă neschimbată. Inițial, în această formă a fost formulată legea constanței compoziției substanței. Recunoscând contribuția enormă a lui Dalton la dezvoltarea științei, nu se poate tăcea despre greșeli enervante: negarea structurii moleculare a substanțelor simple, cum ar fi oxigenul, azotul, hidrogenul. Cercetătorul credea că există molecule numai în complexe substanțe chimice. Având în vedere autoritatea enormă a lui Dalton în comunitatea științifică, erorile sale au afectat negativ dezvoltarea chimiei.

Cum putem cântări atomi și molecule
Descoperirea unui astfel de postulat chimice, legea constanței compoziției materiei, a fost posibilă datorită conceptului de conservare a substanțelor în masă, nereacționat și formate ulterior. Mai mult Dalton măsurarea masa atomică realizată I. precizie Berzelius a tabelului greutăți atomice ale elementelor chimice și a ofertei avansate desemnarea lor ca litere latine. În prezent, masa atomilor și a moleculelor este determinată de carbon nanotub. Rezultatele obținute în aceste studii confirmă legile existente ale chimiei. Anterior, oamenii de știință au folosit un dispozitiv cum ar fi un spectrometru de masă, dar tehnica de cântărire complicată a reprezentat un dezavantaj serios în spectrometrie.

De ce este importantă legea conservării masei de substanțe?
Postulatul chimic menționat mai sus, formulat de MV Lomonosov, dovedește faptul că, în timpul reacției, atomii care alcătuiesc reactivii și produsele nu dispăresc nicăieri și apar din nimic. Cantitatea lor rămâne neschimbată înainte și după procesul chimic. Din moment ce masa atomilor este constantă, acest fapt duce logic la legea conservării masei și energiei. În plus, omul de știință a declarat această regularitate ca un principiu universal al naturii, confirmând interconversia energiei și constanța compoziției materiei.
Ideile lui Proust ca confirmare a teoriei moleculare atomice
Să ne îndreptăm spre descoperirea unui astfel de postulat drept legea constanței compoziției. Chimia de la sfarsitul anilor 18 - începutul secolului al 19-lea - o știință în care oamenii de știință au fost dispute între cei doi oameni de știință francezi, J. Proust și K. Berthollet. Primul a afirmat că compoziția substanțelor formate ca rezultat al reacției chimice depinde în principal de natura reactivilor. Berthollet era sigur că cantitatea relativă de substanțe interacționate afectează și compoziția compușilor-produși de reacție. Cele mai multe chimiști din primele studii au sprijinit ideea de Proust, care le-a formulat după cum urmează: compoziția compusului complex este întotdeauna constantă și nu depinde de specificațiile de modul în care a fost primită. Cu toate acestea, un studiu ulterior al soluțiilor lichide și solide (aliaje) a confirmat gândurile lui K. Berthollet. La aceste substanțe legea constanței de compoziție nu a fost aplicabilă. Mai mult decât atât, nu funcționează pentru compușii cu laturi de cristal ionic. Compoziția acestor substanțe depinde de metodele prin care sunt extrase.
Fiecare substanță chimică, indiferent de metoda de preparare a acesteia, are o compoziție calitativă și cantitativă constantă. Această formulare caracterizează legea constanței compoziției materiei, propusă de J. Proust în 1808. Ca dovadă, el citează următoarele exemple figurative: malachitul din Siberia are aceeași compoziție ca și mineralul extras în Spania - există doar un material cinabru în lume și nu contează din ce domeniu a fost obținut. Astfel, Proust a subliniat constanța compoziției materiei, indiferent de locul și metoda de extracție.
Nu există reguli fără excepții
Din legea constanței compoziției rezultă că, în formarea unui compus complex, elementele chimice sunt combinate unele cu altele în anumite raporturi de greutate. Curând în știința chimică au apărut informații despre existența substanțelor care au o compoziție variabilă, care depinde de metoda de producție. Omul de știință rus M. Kurnakov a sugerat numirea acestor compuși berthollides, de exemplu oxid de titan, apă grea, zirconiu.

Aceste substanțe au o cantitate diferită de alt element pentru 1 parte din greutatea unui element. Astfel, într-un compus binar binar cu galiu, o parte din greutate de galiu reprezintă 1,24 până la 1,82 părți de bismut. Mai târziu, chimiștii a constatat că, în plus față de compușii metalici unul cu altul, substanța nu respectă legea compoziție constantă, este într-o astfel de clasa de compuși anorganici, ca oxizi. Bertollidele sunt, de asemenea, caracteristice pentru sulfuri, carburi, nitruri și hidruri.
Rolul izotopilor
După ce a primit la dispoziția sa legea constanței materiei, chimia ca știință exactă ar putea lega caracteristica de greutate a unui compus cu conținutul izotopic al elementelor care îl formează. Reamintim că izotopii iau în considerare atomii dintr-un element chimic cu proton identic, dar numere diferite de nucleoni. Luând în considerare prezența izotopilor, este clar că compoziția în greutate a compusului poate fi variabilă cu condiția ca elementele care intră în această substanță să fie constante. Dacă elementul mărește conținutul oricărui izotop, atunci se modifică și compoziția în greutate a substanței. De exemplu, apa obișnuită conține 11% hidrogen, iar apa grea formată din izotopul său (deuteriu) este de 20%.
Caracteristicile berthollidelor
Așa cum am explicat deja, legile de conservare din chimie confirmă propozițiile de bază ale teoriei moleculare atomice și sunt absolut adevărate pentru substanțele compozite constante-daltonide. O berthollide are granițe în care este posibilă schimbarea părților în greutate ale elementelor. De exemplu, în oxidul titanului tetravalent, o parte din greutatea metalului este de la 0,65 până la 0,67 părți oxigen. Substanțele unei compoziții neconstante nu au o structură moleculară, laturile lor cristalice constau din atomi. Prin urmare, formulele chimice ale compușilor reflectă doar limitele compoziției lor. Diferitele substanțe sunt diferite. Temperatura poate influența, de asemenea, intervalele de schimbare a compoziției în greutate a elementelor. Dacă două elemente chimice formează mai multe berthollide între ele, atunci legea relațiilor multiple este, de asemenea, inaplicabilă pentru ei.

Din toate exemplele de mai sus, să tragem o concluzie: teoretic în chimie există două grupe de substanțe: cu o compoziție constantă și variabilă. Prezența în natură a acestor compuși servește ca o confirmare excelentă a teoriei moleculare atomice. Dar legea constanței compoziției în sine nu mai este dominantă în știința chimică. Dar ilustrează în mod clar istoria dezvoltării sale.
 Clasificarea științelor naturii
Clasificarea științelor naturii Materie în filosofie
Materie în filosofie Ce contează? Care sunt clasele de substanțe. Diferența dintre substanțele organice și anorganice
Ce contează? Care sunt clasele de substanțe. Diferența dintre substanțele organice și anorganice Legea constanței compoziției: formulare, exemple, semnificație
Legea constanței compoziției: formulare, exemple, semnificație Masa moleculară a oxigenului. Care este masa molară de oxigen?
Masa moleculară a oxigenului. Care este masa molară de oxigen? Știința naturii este ... Tipuri de cunoaștere științifică a naturii
Știința naturii este ... Tipuri de cunoaștere științifică a naturii De ce știința este motorul progresului științific și tehnologic? Interrelația dintre știință și…
De ce știința este motorul progresului științific și tehnologic? Interrelația dintre știință și… Chimie: concepte de bază, definiții, termeni și legi
Chimie: concepte de bază, definiții, termeni și legi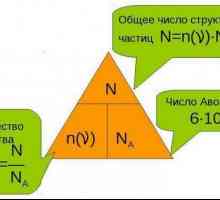 Care este cantitatea de materie și cum este determinată?
Care este cantitatea de materie și cum este determinată? Cum se determină compoziția calitativă și cantitativă a materiei
Cum se determină compoziția calitativă și cantitativă a materiei Esența reacției chimice. Legea conservării substanțelor în masă (chimie)
Esența reacției chimice. Legea conservării substanțelor în masă (chimie) Ce studiază fizica
Ce studiază fizica Legile fundamentale ale chimiei
Legile fundamentale ale chimiei Structura materiei
Structura materiei Ce este mecanica cuantică?
Ce este mecanica cuantică? Fizica moleculară
Fizica moleculară Științe tehnice. Scurt istoric, exemple
Științe tehnice. Scurt istoric, exemple Științele exacte - care sunt ele
Științele exacte - care sunt ele Teoria moleculare-cinetică - este vorba despre minuțioase
Teoria moleculare-cinetică - este vorba despre minuțioase Chimia este incitantă!
Chimia este incitantă! Principalele secțiuni ale chimiei: descriere, caracteristici și fapte interesante
Principalele secțiuni ale chimiei: descriere, caracteristici și fapte interesante
 Ce contează? Care sunt clasele de substanțe. Diferența dintre substanțele organice și anorganice
Ce contează? Care sunt clasele de substanțe. Diferența dintre substanțele organice și anorganice Legea constanței compoziției: formulare, exemple, semnificație
Legea constanței compoziției: formulare, exemple, semnificație Masa moleculară a oxigenului. Care este masa molară de oxigen?
Masa moleculară a oxigenului. Care este masa molară de oxigen? Știința naturii este ... Tipuri de cunoaștere științifică a naturii
Știința naturii este ... Tipuri de cunoaștere științifică a naturii De ce știința este motorul progresului științific și tehnologic? Interrelația dintre știință și…
De ce știința este motorul progresului științific și tehnologic? Interrelația dintre știință și… Chimie: concepte de bază, definiții, termeni și legi
Chimie: concepte de bază, definiții, termeni și legi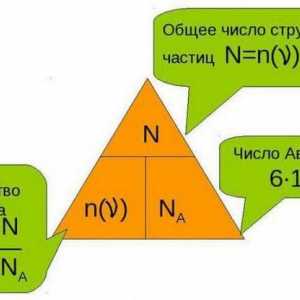 Care este cantitatea de materie și cum este determinată?
Care este cantitatea de materie și cum este determinată? Cum se determină compoziția calitativă și cantitativă a materiei
Cum se determină compoziția calitativă și cantitativă a materiei Esența reacției chimice. Legea conservării substanțelor în masă (chimie)
Esența reacției chimice. Legea conservării substanțelor în masă (chimie)