Gradul de oxidare este ce valoare? Cum de a determina gradul de oxidare a elementelor?
Un astfel de subiect al curriculumului școlar ca și chimia provoacă numeroase dificultăți pentru majoritatea elevilor moderni, puțini pot determina gradul de oxidare a compușilor. Cele mai mari dificultăți pentru elevii care studiază chimie anorganică,
conținut
- Ce subiecte ale cursului de chimie sunt cele mai dificile pentru elevi?
- Regulile acordului
- Algoritm pentru oxizi de acizi
- Compilarea formulelor cu două elemente
- Algoritm pentru stabilirea valorilor numerice în oxizi de bază
- Aranjamentul gradelor de oxidare în acizii care conțin oxigen
- Aranjamentul gradelor de oxidare în săruri
- Termeni de bază în ovr
- Reguli pentru analiza iad
- Exemplu de obr
- Aplicarea proceselor
Profesorii aloca un anumit număr de motive pentru acest lucru elevii „nu-i plăcea“ în elevii secundar și liceu în chimie: refuzul de a înțelege termenii chimice complexe, incapacitatea de a utiliza algoritmi pentru un anumit proces, cunoașterea matematică a problemei. Ministerul Educației al Federației Ruse a introdus o schimbare majoră în conținutul subiectului. În plus, "tăiat" și numărul de ore pentru predarea chimiei. Acest lucru a afectat negativ calitatea cunoașterii pe această temă, o scădere a interesului pentru studiul disciplinei.

Ce subiecte ale cursului de chimie sunt cele mai dificile pentru elevi?
În cadrul noului program în cadrul disciplinei „Chimie“ școală de bază include mai multe teme majore: tabelul periodic al elementelor Mendeleev, substanțe anorganice clase, schimb de ioni. Este foarte dificil pentru elevii de clasa a opta să determine starea de oxidare a oxizilor.
Regulile acordului
În primul rând, studenții ar trebui să fie conștienți de faptul că oxizii sunt compuși complexi cu doi elemente, în care este inclus oxigenul. O condiție obligatorie pentru ca compusul binar să aparțină clasei de oxizi este poziția oxigenului din al doilea compus din acest compus.
Calculați un astfel de indicator în orice formule din această clasă vor fi obținute numai dacă studentul are un anumit algoritm.
Algoritm pentru oxizi de acizi
În primul rând, observăm că gradele oxidarea este expresii numerice pentru valența elementelor. Oxizii acide sunt formați din metale nemetalice sau metale cu o valență de patru până la șapte, al doilea în oxizi în mod necesar oxigen.
În oxizi, valența de oxigen corespunde întotdeauna la două, se poate determina din tabelul periodic al elementelor lui DI Mendeleyev. Un astfel de tip nonmetal ca oxigenul, fiind în grupa a 6-a din subgrupul principal al mesei periodice, ia doi electroni pentru a-și completa complet nivelul de energie externă. Nonmetalele din compușii cu oxigen au cel mai adesea o valență mai mare, care corespunde numărului grupului însuși. Este important să reamintim că gradul de oxidare a elementelor chimice este un indicator care presupune un număr pozitiv (negativ).
Nonmetalul de la începutul formulei are o stare de oxidare pozitivă. Oxidul nemetalic în oxizi este stabil, indicele său fiind -2. Pentru a verifica fiabilitatea distribuirii valorilor în oxizi acide, va trebui să înmulțiți toate numerele pe care le puneți pe indicii unui anumit element. Calculele sunt considerate fiabile dacă suma totală a argumentelor pro și contra pentru gradele livrate este 0.

Compilarea formulelor cu două elemente
Gradul de oxidare a atomilor de elemente oferă șansa de a crea și înregistra conexiuni din două elemente. Când se creează o formulă, pentru început, ambele simboluri sunt prescrise unul lângă altul, oxigenul trebuie plasat pe locul doi. Pe partea de sus a fiecăreia dintre mărcile înregistrate valoarea prescrisă a gradelor de oxidare, atunci există între numere este numărul care va fi fără nici un divizibil în mod egal de ambele numere. Acest indicator trebuie separat separat de valoarea numerică a gradului de oxidare, obținându-se indicii pentru prima și a doua componentă a substanței cu două elemente. stare de oxidare mai mare este numeric egal cu valoarea mai mare de valență nemetal tipic este identic cu numărul de grup, în care PS este un metaloid.

Algoritm pentru stabilirea valorilor numerice în oxizi de bază
Compușii similari sunt oxizi ai metalelor tipice. Aceștia din toți compuși au un indice de oxidare de cel mult +1 sau +2. Pentru a înțelege care va fi gradul de oxidare a metalului, putem folosi sistemul periodic. În metalele principalelor subgrupe din primul grup, acest parametru este întotdeauna constant, este similar numărului de grup, adică +1.
Metalele din subgrupul principal al celui de-al doilea grup sunt, de asemenea, caracterizate printr-un grad stabil de oxidare, în termeni numerici +2. Gradul de oxidare în cantitate de oxizi în vederea indicilor acestora (numerele) trebuie să dea la zero, deoarece substanța chimică este considerată o moleculă neutră, lipsită de o particulă de încărcare.
Aranjamentul gradelor de oxidare în acizii care conțin oxigen
Acizii sunt substanțe complexe constând din unul sau mai mulți atomi de hidrogen, care sunt asociate cu unele reziduuri acide. Dat fiind că stările de oxidare sunt indicatori digitali, vor fi necesare anumite abilități matematice pentru a le calcula. Un astfel de indicator pentru hidrogen (proton) în acizi este întotdeauna stabil, este +1. Apoi puteți indica gradul de oxidare pentru un ion de oxigen negativ, este de asemenea stabil, -2.
Doar după aceste acțiuni, este posibil să se calculeze gradul de oxidare în componenta centrală a formulei. Ca o mostră specifică, să luăm în considerare determinarea gradului de oxidare a elementelor în acid sulfuric H2SO4. Considerând că în molecula unei substanțe complexe dat conține doi protoni de hidrogen, patru atomi de oxigen, obținem o expresie de acest tip + 2 + X-8 = 0. Pentru ca totalul să formeze zero, sulful va avea o stare de oxidare de +6
Aranjamentul gradelor de oxidare în săruri
Sărurile sunt compuși complexi constând din ioni metalici și unul sau mai multe reziduuri acide. Procedura de determinare a gradelor de oxidare în fiecare dintre constituenți într-o sare complexă este aceeași ca în acizii care conțin oxigen. Dat fiind faptul că gradul de oxidare a elementelor este un indicator digital, este important să se identifice corect gradul de oxidare a metalului.
Dacă metalul care formează sarea este localizat în subgrupul principal, starea lui de oxidare va fi stabilă, corespunzătoare numărului de grup, este o valoare pozitivă. Dacă sarea conține un metal similar cu subgrupa PS, prezentând diferite valența, determină valența metalul poate fi prin reziduu acid. Odată ce starea de oxidare a metalului este stabilită, gradul de oxidare a oxigenului (-2), atunci gradul de oxidare al elementului central este calculat folosind ecuația chimică.
De exemplu, să luăm în considerare definiția stărilor de oxidare pentru elementele din Azotat de sodiu (sare medie). NaNO3. Sarea este formată din metalul principalului subgrup al grupului 1, prin urmare, gradul de oxidare a sodiului va fi +1. Oxigenul din nitrați are un grad de oxidare de -2. Pentru a determina valoarea numerică a gradului de oxidare, ecuația este + 1 + X-6 = 0. Rezolvând această ecuație, obținem că X trebuie să fie +5, asta este gradul de oxidare a azotului.

Termeni de bază în OVR
Pentru oxidare, precum și procesul de recuperare, există termeni specifici pe care elevii trebuie să le învețe.
Gradul de oxidare a unui atom este abilitatea directă de a atașa (pentru a da altora) electroni de la niște ioni sau atomi.
Oxidantul este considerat a fi atomi neutri sau ioni încărcați, în timpul unei reacții chimice îi atașează electronii.
Restauratorul va fi atomi descărcați sau ioni încărcați, care își pierd propriii electroni în procesul de interacțiune chimică.
Oxidarea este reprezentată ca o procedură pentru eliberarea electronilor.
Recuperarea este asociată cu acceptarea de electroni suplimentari de către un atom sau ion neîncărcat.
Procesul de oxidare-reducere este caracterizat printr-o reacție, în timpul căreia gradul de oxidare a atomului se modifică în mod necesar. Această definiție ne permite să înțelegem cum este posibil să determinăm dacă reacția OVR este.

Reguli pentru analiza IAD
Folosind acest algoritm, puteți aranja coeficienții în orice reacție chimică.
În primul rând, trebuie să aranjați în fiecare substanță chimică gradul de oxidare. Rețineți că într-o substanță simplă gradul de oxidare este zero, deoarece nu există recul (atașare) de particule negative. Regulile pentru aranjarea gradelor de oxidare în substanțele binare și cele cu trei elemente au fost considerate mai sus.
Apoi, este necesar să se determine acei atomi sau ioni în care stările de oxidare s-au schimbat în cursul transformării care a avut loc.
Din partea stângă a ecuației înregistrate, atomii sau ionii încărcați sunt separați, care și-au schimbat stările de oxidare. Acest lucru este necesar pentru echilibrare. Elementele sunt întotdeauna indicate de valorile lor.
Mai mult, acei atomi sau ioni care au fost formați în timpul reacției sunt scrise, indicate de semnul + numărul de electroni luați de atom, - numărul de particule negative care sunt returnate. Dacă nivelurile de oxidare scad după procesul de reacție. Aceasta înseamnă că electronii au fost luați de un atom (ion). Cu o creștere a gradului de oxidare, atomul (ionul) în timpul reacției eliberează electroni.
Cel mai mic număr total este împărțit mai întâi în coeficienții primiți, apoi la electronii transferați în proces. Numerele găsite sunt coeficienții stereochimici necesari.
Determinați oxidantul, agentul reducător, procesele care apar în timpul reacției.
Ultimul pas va fi dispunerea coeficienților stereochimici în reacția luată în considerare.
Exemplu de OBR
Luați în considerare aplicarea practică a acestui algoritm la o reacție chimică specifică.
Fe + CuSO4 = Cu + FeS04
Calculăm parametrii pentru toate substanțele simple și complexe.
Deoarece Fe și Cu sunt substanțe simple starea lor de oxidare este 0. CuSO4, de Cu + 2, apoi 2 atomi de oxigen, sulf și la +6. În FeSO4: Fe +2, prin urmare, pentru O-2, conform calculelor lui S +6.
Acum căutăm elemente care ar putea schimba indicatorii, în situația noastră vor fi Fe și Cu.

Deoarece după reacție valoarea atomului de fier a devenit +2, în reacție au fost eliberați doi electroni. Cuprul și-a schimbat performanța de la +2 la 0, prin urmare, cuprul a luat doi electroni. Acum determinăm numărul de electroni primiți și date date de atomul de fier și de cationul cuprului bivalent. În cursul transformării, doi electroni sunt luați de cationul cuprului bivalent, același număr de electroni este dat de atomul de fier.
În acest proces, nu are nici un sens să se determine multiplele minime comune, deoarece un număr egal de electroni este acceptat și dat în timpul transformării. Coeficienții stereochimici vor corespunde, de asemenea, unității. În reacție, proprietățile agentului reducător vor prezenta fier, în timp ce îl vor oxida. Catia cuprului bivalent este redusă la cuprul pur, în reacție are cel mai înalt grad de oxidare.

Aplicarea proceselor
Formulele pentru gradul de oxidare ar trebui să fie cunoscute fiecărui elev de gradul 8-9, deoarece această întrebare este inclusă în sarcinile OGE. Orice proces care apare cu semnele oxidative, restaurative joacă un rol important în viața noastră. Fără ele, procesele metabolice din corpul uman sunt imposibile.
 Forme de școlarizare - o varietate de clasificări.
Forme de școlarizare - o varietate de clasificări. Reacția compusului: Exemple și formule
Reacția compusului: Exemple și formule Determinați valența elementelor chimice
Determinați valența elementelor chimice Chimie: oxizi, clasificarea și proprietățile lor
Chimie: oxizi, clasificarea și proprietățile lor Ce face un chimist?
Ce face un chimist? Evaluarea criterială a realizărilor elevilor
Evaluarea criterială a realizărilor elevilor Ce este OVR în chimia modernă?
Ce este OVR în chimia modernă? Alegeți cei mai puternici oxidanți
Alegeți cei mai puternici oxidanți Care este schema de echilibrare electronică?
Care este schema de echilibrare electronică? Cum să înveți chimia de la zero: moduri eficiente
Cum să înveți chimia de la zero: moduri eficiente Chimie anorganică este ce? Chimie anorganică în curriculumul școlar
Chimie anorganică este ce? Chimie anorganică în curriculumul școlar Compuși complexi: nomenclatură și clasificare
Compuși complexi: nomenclatură și clasificare Caracteristicile și conținutul `Literaturii` pentru gradul 8 Korovin V.Ya.
Caracteristicile și conținutul `Literaturii` pentru gradul 8 Korovin V.Ya. Sărbătoarea din 1 septembrie - Ziua cunoașterii
Sărbătoarea din 1 septembrie - Ziua cunoașterii Reacții de oxidare-reducere
Reacții de oxidare-reducere Clasele de vârstă: orientarea profesională în școală
Clasele de vârstă: orientarea profesională în școală Exemple de reacții de reducere a oxidării cu soluție. OVR: scheme
Exemple de reacții de reducere a oxidării cu soluție. OVR: scheme Cum să aranjăm coeficienții în ecuațiile chimice? Ecuatii chimice
Cum să aranjăm coeficienții în ecuațiile chimice? Ecuatii chimice Principalele secțiuni ale chimiei: descriere, caracteristici și fapte interesante
Principalele secțiuni ale chimiei: descriere, caracteristici și fapte interesante Gradul de oxidare a azotului - învățăm să înțelegem
Gradul de oxidare a azotului - învățăm să înțelegem Bazele chimiei anorganice. Grad de oxidare
Bazele chimiei anorganice. Grad de oxidare
 Reacția compusului: Exemple și formule
Reacția compusului: Exemple și formule Determinați valența elementelor chimice
Determinați valența elementelor chimice Chimie: oxizi, clasificarea și proprietățile lor
Chimie: oxizi, clasificarea și proprietățile lor Ce face un chimist?
Ce face un chimist? Evaluarea criterială a realizărilor elevilor
Evaluarea criterială a realizărilor elevilor Ce este OVR în chimia modernă?
Ce este OVR în chimia modernă?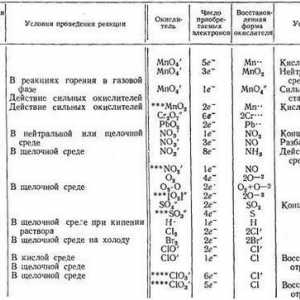 Alegeți cei mai puternici oxidanți
Alegeți cei mai puternici oxidanți Care este schema de echilibrare electronică?
Care este schema de echilibrare electronică? Cum să înveți chimia de la zero: moduri eficiente
Cum să înveți chimia de la zero: moduri eficiente Chimie anorganică este ce? Chimie anorganică în curriculumul școlar
Chimie anorganică este ce? Chimie anorganică în curriculumul școlar