Care alcani sunt caracterizați prin reacții
Fiecare clasă de compuși chimici este capabilă să prezinte proprietăți datorită structurii lor electronice. Alcanii se caracterizează prin reacții de substituție, scindare sau oxidare a moleculelor. Toate procesele chimice au propriile caracteristici de percolare, care vor fi discutate mai târziu.
conținut
Ce sunt alcani
Acestea sunt compuși de hidrocarburi saturate, numite parafine. Moleculele lor constau doar din atomi de carbon și de hidrogen, au un lanț aciclic liniar sau ramificat, în care există numai compuși singuri. Având în vedere caracteristicile clasei, este posibil să se calculeze care sunt reacțiile caracteristice ale alcanilor. Ei se supun formulei pentru întreaga clasă: H2n + 2Cn.
Structura chimică
Moleculă de parafină include atomi de carbon care prezintă sp3-hibridizare. Toate cele patru orbite de valență au aceeași formă, energie și direcție în spațiu. Unghiul dintre nivelele de energie este de 109 ° și 28 `.
Prezența unor legături simple în molecule determină care sunt reacțiile caracteristice pentru alcani. Sunt prezenți sigma - conexiuni. Legătura dintre carbonii este nepolară și slab polarizabilă, este puțin mai lungă decât în Cminus-H. De asemenea, se observă o schimbare a densității electronilor la atomul de carbon, ca cea mai electronegativă. Ca rezultat, compusul Cminus-H este caracterizat printr-o polaritate scăzută.
Reacții de substituție
Substanțele din clasa parafinelor au o activitate chimică slabă. Acest lucru poate fi explicat prin puterea legăturilor dintre Cminus-C și Cminus-H, care sunt greu de rupt din cauza nepopularității. Distrugerea lor se bazează pe mecanismul homolitic, în care participă radicalii de tip liber. Acesta este motivul pentru care alcani sunt caracterizați prin reacții de substituție. Astfel de substanțe nu sunt capabile să interacționeze cu moleculele de apă sau cu ionii de încărcare.
Acestea sunt considerate a fi o substituție cu radicali liberi, în care atomii de hidrogen sunt înlocuiți cu elemente halogen sau alte grupări active. Astfel de reacții includ procesele asociate cu halogenarea, sulfoclorurarea și nitrarea. Rezultatul lor este producția de derivați de alcani. În centrul mecanismului reacțiilor de substituție în tipul radicalilor liberi se află principalele trei etape:
În centrul mecanismului reacțiilor de substituție în tipul radicalilor liberi se află principalele trei etape:
- Procesul începe cu inițierea sau nuclearea unui lanț, ca rezultat al formării radicalilor liberi. Catalizatorii sunt surse de lumină ultravioletă și încălzire.
- Apoi, se dezvoltă un lanț, în care se efectuează interacțiuni succesive ale particulelor active cu molecule inactive. Transformarea lor în molecule și radicali, respectiv.
- Ultimul pas este o pauză de lanț. Se observă recombinarea sau dispariția particulelor active. Astfel, dezvoltarea reacției în lanț încetează.
Procesul de halogenare
Se bazează pe un mecanism de tip radical. Reacția de halogenare a alcanilor se efectuează prin iradiere cu ultraviolet și încălzirea unui amestec de halogeni și hidrocarburi.
Toate etapele procesului sunt supuse regulii exprimate de Markovnikov. Acesta precizează că este supus substituției cu halogen, în primul rând, un atom de hidrogen, care aparține carbonului hidrogenat însuși. Halogenația are loc într-o astfel de succesiune: de la atomul terțiar până la carbonul primar.
Procesul este mai bun pentru moleculele de alcani cu un lanț lung de carbon principal. Acest lucru se datorează scăderii energiei ionizante într-o anumită direcție, electronul fiind mai ușor despărțit de substanță.
Un exemplu este clorurarea moleculei de metan. Acțiunea ultravioletului conduce la despicarea clorului în particule radicale, care efectuează un atac asupra alcanului. Există o detașare a hidrogenului atomic și formarea lui H3Radicalul Cmiddot sau metil. O astfel de particulă, la rândul ei, atacă clorul molecular, ducând la distrugerea structurii sale și la formarea unui nou reactiv chimic.
În fiecare etapă a procesului, se înlocuiește doar un atom de hidrogen. Reacția de halogenare a alcanilor conduce la formarea treptată a unei molecule de clorometan, diclormetan, triclormetan și tetraclormetan.
Schema procedeului este după cum urmează:
H4C + Cl: CI-H3CCI + HCI,
H3CCI + Cl: Cl -> H2CCU2 + HCI,
H2CCU2 + Cl: Cl -> HCI3 + HCI,
HCCl3 + Cl: Cl -> CCI4 + HCI.
Spre deosebire de clorurarea moleculei de metan, efectuarea unui astfel de procedeu cu alte alcani se caracterizează prin obținerea de substanțe în care substituția hidrogenului nu are loc la un atom de carbon, ci la mai multe. Relația lor cantitativă este legată de temperatură. În condiții reci, viteza de formare a derivaților cu structură terțiară, secundară și primară scade.
Odată cu creșterea indicelui de temperatură, viteza de formare a acestor compuși este egalizată. Procesul de halogenare este influențat de factorul static, ceea ce indică o altă probabilitate ca un radical să se ciocnească cu un atom de carbon.

Procesul de halogenare cu iod nu are loc în condiții normale. Este necesar să se creeze condiții speciale. Când este expus la metan cu acest halogen, apare iodură de hidrogen. Acesta este afectat de iodura de metil, ca urmare, reactivi originali sunt eliberate: metan si iod. O astfel de reacție este considerată reversibilă.
Reacția Wurz pentru alcani
Este o metodă de obținere hidrocarburi saturate cu o structură simetrică. Substanțele reactive sunt metalul de sodiu, bromurile de alchil sau clorurile de alchil. Când interacționează, se obține halogenură de sodiu și un lanț de hidrocarburi mărit, care este suma a doi radicali de hidrocarburi. Schema, sinteza este după cum urmează: Rminus-Cl + Clminus-R + 2Na → Rminus-R + 2NaCI.
Reacția Wurz pentru alcani este posibilă numai dacă în moleculele lor halogenii sunt localizați la atomul de carbon primar. De exemplu, CH3minus-CH2minus-CH2Br.
Dacă un amestec de hidrocarburi halogen-hidrocarbură a doi compuși participă la proces, se formează trei produse diferite atunci când lanțurile lor sunt condensate. Un exemplu al unei astfel de reacții alcanice este interacțiunea sodiului cu clorometan și cloretan. Producția este un amestec care conține butan, propan și etan.
În plus față de sodiu, puteți utiliza alte metale alcaline, care includ litiu sau potasiu.
Procesul de sulfochlorinare
Se mai numește reacția lui Reed. Ea curge în conformitate cu principiul înlocuirii radicalilor liberi. Acesta este un tip tipic de reacție a alcanilor la acțiunea unui amestec de dioxid de sulf și clor molecular în prezența radiației ultraviolete.
Procesul începe cu inițierea unui mecanism de lanț, în care doi radicali sunt obținuți din clor. Unul dintre aceștia atacă alcanul, ceea ce duce la apariția unei particule de alchil și a unei molecule de acid clorhidric. Dioxidul de sulf este atașat la radicalul hidrocarbonat pentru a forma o particulă complexă. Pentru stabilizare, un atom de clor este capturat dintr-o altă moleculă. Substanța finală este clorura de alcansulfonil, se folosește în sinteza compușilor cu suprafață activă.
Schematic, procesul arata astfel:
ClCl →hv ∙ Cl + ∙ Cl,
HR + ∙ Cl → R ∙ + HCI,
R ∙ + OSO → ∙ RSO2,
∙ RSO2 + ClCl → RSO2Cl + Cl.
Procesele asociate cu nitrarea
Alcani reacționează cu un acid azotic sub formă de soluție de 10% și de asemenea cu azotul unui oxid tetravalent în stare gazoasă. Condițiile de trecere sunt valori ridicate ale temperaturii (aproximativ 140 ° C) și valori scăzute ale presiunii. La ieșire se produc nitro-alcani.
Acest proces liber radical a fost numit după omul de știință Konovalov, care a descoperit sinteza nitrării: CH4 + HNO3 → CH3NU2 + H2O.
Mecanismul divizării
Pentru alcani, reacțiile de dehidrogenare și de cracare sunt caracteristice. Molecula de metan suferă o descompunere termică completă.
Principalul mecanism al reacțiilor de mai sus este eliminarea atomilor din alcani.
Procesul de dehidrogenare
Atunci când se separă atomii de hidrogen de scheletul de carbon al parafinelor, cu excepția metanului, se obțin compuși nesaturați. Astfel de reacții chimice ale alcanilor au loc în condiții de temperatură ridicată (de la 400 la 600 ° C) și sub acțiunea acceleratoarelor sub formă de platină, nichel, crom oxizi și aluminiu.
Dacă reacția implică moleculele de propan sau etan, atunci produsele sale vor fi propene sau etane cu o dublă legătură.
Când scheletul de patru sau cinci atomi de carbon este dehidrogenat, se obțin compuși dienici. Butanul este format din butan-1,3 și butadien-1,2.
Dacă reacția conține substanțe cu 6 sau mai mulți atomi de carbon, atunci se formează benzen. Are un nucleu aromatic cu trei legături duble.
Procesul asociat cu descompunerea
În condiții de temperatură ridicată, reacțiile alcanilor pot continua cu ruperea legăturilor de carbon și formarea de particule active de tip radical. Astfel de procese se numesc fisuri sau pirolize.
Încălzirea reactanților la temperaturi de peste 500 ° C duce la descompunerea moleculelor lor, în timpul cărora se formează amestecuri complexe de radicali alchil.
Realizarea unei încălziri puternice a pirolizei alcanilor cu lanțuri lungi de carbon este asociată cu obținerea de compuși limitați și nesaturați. Se numește cracare termică. Acest proces a fost folosit până la mijlocul secolului al XX-lea.
Dezavantajul era producerea de hidrocarburi cu un număr scăzut de cifre octanice (nu mai mult de 65), deci a fost înlocuit cracare catalitică. Procesul are loc în condiții de temperatură sub 440 ° C și presiuni mai mici de 15 atmosfere, în prezența unui accelerator aluminosilicat, cu eliberarea de alcani având o structură ramificată. Un exemplu este piroliza metanului: 2CH4 →T°C2H2+ 3H2. În timpul acestei reacții se formează acetilenă și hidrogen molecular.
O moleculă de metan poate fi transformată. Pentru o astfel de reacție, sunt necesare apă și un catalizator de nichel. Producția este un amestec de monoxid de carbon și hidrogen.
Procesele de oxidare
Reacțiile chimice caracteristice alcanilor sunt legate de eliberarea electronilor.
Există o auto-oxidare a parafinelor. Aceasta implică un mecanism al radicalilor liberi de oxidare a hidrocarburilor saturate. În timpul reacției, hidroperoxidurile se obțin din faza lichidă a alcanilor. În stadiul inițial, molecula de parafină interacționează cu oxigenul, ducând la eliberarea radicalilor activi. Mai mult, cu o particulă de alchil, o altă moleculă O2, se pare că ∙ ROO. Cu radicalul de acid gras peroxi, se contactează o moleculă de alcan, după care se eliberează hidroperoxidul. Un exemplu este auto-oxidarea etanului:
C2H6 + O2 → ∙ C2H5 + HOO ∙,
∙ C2H5 + O2 → ∙ OOC2H5,
∙ OOC2H5 + C2H6 → HOOC2H5 + ∙ C2H5.
Alcanii sunt caracterizați prin reacții de combustie, care aparțin principalelor proprietăți chimice, atunci când sunt determinate în compoziția combustibilului. Au caracter oxidativ cu eliberare de căldură: 2C2H6 + 7o2 → 4CO2 + 6H2O.
Dacă se observă o cantitate mică de oxigen în procedeu, produsul final poate fi carbonul sau oxidul bivalent de carbon, care este determinat de concentrația de O2.
La oxidarea alcanilor sub influența substanțelor catalitice și încălzirea la 200 ° C, se obțin molecule de alcool, aldehidă sau acid carboxilic.
Exemplu cu etan:
C2H6 + O2 → C2H5OH (etanol),
C2H6 + O2 → CH3CHO + H2O (etanol și apă),
2C2H6 + 3O2 → 2CH3COOH + 2H2O (acid etanolic și apă).
Alcanii pot fi oxidați prin acțiunea peroxidelor ciclice tri-membri pe ele. Acestea includ dimetildioxiran. Rezultatul oxidării parafinelor este o moleculă de alcool.
Reprezentanții parafinelor nu reacționează la KMnO4 sau permanganat de potasiu, precum și apă cu brom.
izomerizare
Pentru alcani, tipul de reacție este caracterizat prin substituirea cu un mecanism electrofil. Aceasta este izomerizarea lanțului de carbon. Catalizează acest proces de clorură de aluminiu, care interacționează cu parafina saturată. Un exemplu este izomerizarea unei molecule de butan, care devine 2-metilpropan: C4H10 → C3H7CH3.
Procesul de aromatizare
Substanțele saturate, în care lanțul principal de carbon conține șase sau mai mulți atomi de carbon, sunt capabili de dehidrocilizare. Pentru moleculele scurte, această reacție nu este tipică. Rezultatul este întotdeauna un ciclu de șase membri sub formă de ciclohexan și derivații săi.
În prezența acceleratoarelor de reacție, are loc o dehidrogenare și o conversie ulterioară la un inel benzen mai stabil. Hidrocarburile aciclice sunt transformate în compuși aromatici sau în arene. Un exemplu este dehidrocilizarea hexanului:
H3Cminus-CH2minus- CH2minus- CH2minus- CH2minus-CH3 → C6H12 (Ciclohexan)
C6H12 → C6H6 + 3H2 (Benzen).
 Formula benzenului: care dintre variante este corectă?
Formula benzenului: care dintre variante este corectă? Clasificarea substanțelor organice - baza pentru studiul chimiei organice
Clasificarea substanțelor organice - baza pentru studiul chimiei organice Organic materia caracteristicile și clasificarea lor
Organic materia caracteristicile și clasificarea lor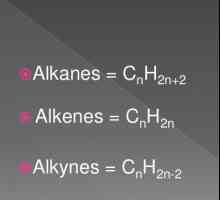 Formula generală a alchenelor. Proprietățile și caracteristicile alkenelor
Formula generală a alchenelor. Proprietățile și caracteristicile alkenelor Cum se fac izomeri și omologi? Cum se fac izomerii alcanilor?
Cum se fac izomeri și omologi? Cum se fac izomerii alcanilor? Hidrocarburi saturate ciclice: cum sunt produse. cicloalcani
Hidrocarburi saturate ciclice: cum sunt produse. cicloalcani Substanțe anorganice
Substanțe anorganice Cum se determină compoziția calitativă și cantitativă a materiei
Cum se determină compoziția calitativă și cantitativă a materiei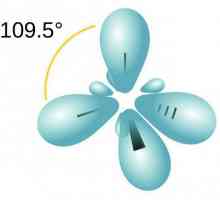 Să vorbim despre cum să determinăm tipul de hibridizare
Să vorbim despre cum să determinăm tipul de hibridizare Ce este o nomenclatură sistematică
Ce este o nomenclatură sistematică Sunt hidrocarburile alifatice?
Sunt hidrocarburile alifatice? Pentan: izomeri și nomenclatură
Pentan: izomeri și nomenclatură Hidrocarburi saturate: proprietăți, formule, exemple
Hidrocarburi saturate: proprietăți, formule, exemple Compuși organici și clasificarea acestora
Compuși organici și clasificarea acestora Proprietăți chimice ale alcanilor
Proprietăți chimice ale alcanilor Hidrocarburi limită: caracteristici generale, izomerie, proprietăți chimice
Hidrocarburi limită: caracteristici generale, izomerie, proprietăți chimice Seria de omologie
Seria de omologie Utilizarea alcanilor
Utilizarea alcanilor Hidrocarburi nesaturate: alcene, proprietăți chimice și aplicații
Hidrocarburi nesaturate: alcene, proprietăți chimice și aplicații Alkanes: proprietăți chimice
Alkanes: proprietăți chimice Izomerii de heptan: o caracteristică generală și o aplicare
Izomerii de heptan: o caracteristică generală și o aplicare
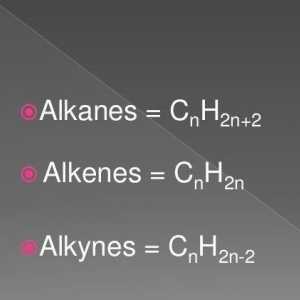 Formula generală a alchenelor. Proprietățile și caracteristicile alkenelor
Formula generală a alchenelor. Proprietățile și caracteristicile alkenelor Cum se fac izomeri și omologi? Cum se fac izomerii alcanilor?
Cum se fac izomeri și omologi? Cum se fac izomerii alcanilor? Hidrocarburi saturate ciclice: cum sunt produse. cicloalcani
Hidrocarburi saturate ciclice: cum sunt produse. cicloalcani Cum se determină compoziția calitativă și cantitativă a materiei
Cum se determină compoziția calitativă și cantitativă a materiei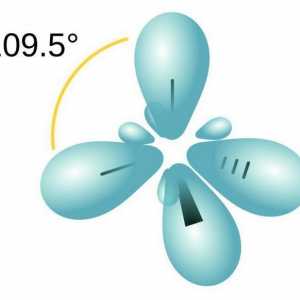 Să vorbim despre cum să determinăm tipul de hibridizare
Să vorbim despre cum să determinăm tipul de hibridizare Ce este o nomenclatură sistematică
Ce este o nomenclatură sistematică Sunt hidrocarburile alifatice?
Sunt hidrocarburile alifatice?