Oxigenul este ... Formula de oxigen. O moleculă de oxigen
Dintre toate substanțele de pe Pământ, un loc special este ocupat de ceea ce oferă viața - gazul de oxigen. Prezenta lui face ca planeta noastra sa fie unica printre toate celelalte. Datorită acestei substanțe, există atât de multe creaturi frumoase în lume: plante, animale, oameni. Oxigenul este un compus absolut indispensabil, unic și extrem de important. Prin urmare, încercați să aflați ce este, ce caracteristici are.
conținut
- Elemente chimice oxigen: caracteristic
- Structura moleculei
- O substanță oxigenă simplă
- Istoria descoperirii
- Proprietăți fizice
- Proprietăți chimice
- Obținerea în industrie
- Intră în laborator
- Modificări alotropice ale oxigenului
- Oxigenul este o componentă a aerului
- Importanța oxigenului în natură
- Utilizarea oxigenului și a ozonului în industrie

Elemente chimice oxigen: caracteristic
În primul rând, caracterizăm locația acestui element în tabelul periodic. Acest lucru se poate face prin mai multe elemente.
- Numărul de serie este de 8.
- Masa atomică este 15.99903.
- Acesta este situat în al șaselea grup al principalului subgrup al celei de-a doua perioade a sistemului.
- taxa nucleară - 8, numărul de protoni - 8, electronul - 8, neutroni - 8. Astfel, un număr dublu magică, în care principalul observat stabilitate formă izotopică 16O.
- Numele latin al elementului este oxigenul. Rusă - oxigen, acest nume este format din expresia "a da naștere acizilor". Există, de asemenea, un sinonim, uneori se numește oxigen.
O atenție deosebită este acordată analizei structurii electronice a atomului, așa cum a fost explicat ei stabilitatea moleculei și prezintă proprietăți fizice și chimice.
Structura moleculei
Configurația electronică a atomului este reprezentată de formula 1s22s22p4. Din această înregistrare este evident că, înainte de finalizarea nivelului de energie și de crearea octetului de legământ, oxigenul nu are doi electroni. Aceasta explică următoarele caracteristici:
- molecula de oxigen este diatomică;
- gradul de oxidare a elementului este întotdeauna -2 (cu excepția peroxizilor și a oxidului de fluor, în care se modifică cu -1 și +2, respectiv);
- este cel mai puternic oxidant;
- ușor de reacționat chiar și în condiții normale;
- este capabil să formeze compuși explozivi.
Acum, ia în considerare problema structurii. Cum se formează o moleculă de oxigen? În primul rând, mecanismul de formare este nonpolar covalent, adică datorită socializării electronilor fiecărui atom. Astfel, legătura este, de asemenea, nepolară covalentă. În acest caz, este dublu, deoarece fiecare dintre atomi are doi electroni nepartiți la nivelul exterioară. Puteți să arătați foarte simplu cum arată oxigenul. Formula este după cum urmează: О2 sau O = O.
Datorită prezenței unei astfel de legături, molecula este foarte stabilă. Pentru numeroasele reacții care implică aceasta, sunt necesare condiții speciale: presiune crescută, încălzire, utilizarea catalizatorilor.
Ca element chimic, oxigenul este un atom care are trei izotopi stabili în mod natural. Numerele lor de masă sunt respectiv 16, 17, 18. Cu toate acestea, raportul procentual este foarte diferit, deoarece 16Aproximativ 99,759%, iar restul este mai puțin de 0,5%. Prin urmare, izotopul cel mai comun și mai stabil este exact cu un număr de masă de 16.

O substanță oxigenă simplă
Dacă vorbim despre acest element ca o simplă conexiune, atunci indicați imediat starea agregată în condiții normale. Oxigenul este un gaz care nu are nici gust, nici culoare, nici miros. O moleculă diatomică, cea mai abundentă substanță de pe planetă, după hidrogen și un gaz nobil de heliu.
Există alte stări agregate ale acestei substanțe. Deci, la o temperatură negativă de -1830C oxigenul se condensează într-un lichid albastru frumos. Dacă depășiți pragul de -2000C, lichidul va depăși cristalele de culoare albastru strălucitor de formă ac monoclinică.
Există trei tipuri principale de existență a oxigenului în stare solidă.
- Forma alfa (alfa-O2). Există o temperatură sub 200 0S.
- Forma beta (beta-O2). Intervalul de temperatură -200-4000S.
- Forma gamma (gamma - O2). Interval de la -400 la -5000S.
Oxigenul este unul dintre cele mai importante și semnificative gaze. Nu numai pentru viața ființelor vii de pe planetă, ci și pentru întreaga natură. Este dificil să numim un mineral sau un compus natural, în care nu ar fi inclus ca element.
Istoria descoperirii
Prima mențiune a faptului că compoziția aerului există orice gaz care susține procesele de ardere, a apărut în secolul VIII. Cu toate acestea, atunci, pentru a-l studia, a demonstra existența și a deschide acolo nu a existat nici o posibilitate tehnică. Numai după aproape un mileniu, în secolul al XVIII-lea, acest lucru a fost făcut, datorită activității mai multor oameni de știință.
- 1771 Karl Scheele a stabilit experimental compoziția aerului și a aflat că principalele două gaze sunt oxigenul și azotul.
- Pierre Bayen efectuează experimente privind descompunerea mercurului și a oxidului său și înregistrează oficial rezultatele.
- 1773 Sheele deschide oficial elementul oxigenului, dar nu îl primește în forma sa pură.
- 1774 Priestley, indiferent de Scheele, face același lucru ca și el și primește oxigen pur prin descompunerea oxidului de mercur.
- 1775 Antoine Lavoisier dă numele acestui element și creează o teorie a arderii care a existat de mai bine de o sută de ani.
- 1898 Thompson face societatea să creadă că oxigenul aerului se poate termina din cauza emisiilor mari de dioxid de carbon în atmosferă.
- În același an, Timiryazev dovedește contrariul, deoarece explică faptul că furnizorul de oxigen este plantele verzi ale planetei.
Astfel, a devenit cunoscut ce este oxigenul, ce este un gaz important și semnificativ. La urma urmelor, au fost studiate proprietățile fizice și chimice ale substanțelor considerate metode de preparare a acestuia, numărate conținutul aproximativ al apei, scoarța pământului și atmosfera și alte părți ale planetei.

Proprietăți fizice
Dăm principalii parametri fizici prin care se poate caracteriza acest compus.
- Oxigenul este un gaz în condiții normale, fiind parte integrantă a aerului (21%). Nu are culoare, gust și miros. Mai ușoară decât aerul, slab solubilă în apă.
- Este absorbit activ de cărbune și pulberi metalice, se dizolvă în substanțe organice.
- Punctul de fierbere este -1830S.
- Se topește -218,350S.
- Densitatea este de 0,0014 g / cm3.
- Grinzile cristaline sunt moleculare.
Oxigenul are proprietăți paramagnetice în stare lichidă.
Proprietăți chimice
Despre modul în care este activă gazul în cauză, cum se comportă în reacțiile cu alte substanțe, este spus în detaliu prin chimie. Oxigenul este capabil să prezinte mai multe grade de oxidare, deși cea mai frecventă este -2, care este considerată constantă. În plus, există compuși în care valorile sunt după cum urmează:
- -1;
- -0,5;
- -1/3;
- +0,5;
- +1;
- +2.
Activitatea chimică este explicată prin afinitatea ridicată a electronului, deoarece valoarea electronegativității conform Polling este de 3,44. Mai mare decât în fluorură (4). Prin urmare, oxigenul este un oxidant foarte puternic. În același timp, în reacțiile cu oxidanți chiar mai puternici se comportă ca un agent reducător, prezentând o stare de oxidare pozitivă. De exemplu, în oxid de fluor+2 F2- .

Există un număr mare de compuși, care includ oxigen. Acestea sunt clasele de substanțe, cum ar fi:
- oxizi;
- peroxizi;
- ozonide;
- dismutaza;
- Acid;
- motive;
- sare;
- molecule organice.
Cu toate elementele de oxigen pot reacționa în condiții normale, cu excepția metalelor prețioase, heliu, neon si argon si halogen. C gaze inerte nu interacționează în nici un fel.
Obținerea în industrie
Conținutul de oxigen în aer și apă este atât de mare (21 și, respectiv 88%), principala cale industrială care sinteza este distilarea fracționată a aerului lichid și electroliza apelor.
Prima metodă este folosită în mod special. La urma urmei, multe gaze pot fi izolate de aer. Cu toate acestea, nu va fi complet curat. Dacă este necesar un produs de o calitate superioară, atunci procesele de electroliză sunt pornite. Materia primă pentru aceasta este fie apă sau alcalină. Hidroxidul de sodiu sau potasiu este utilizat pentru a crește conductivitatea electrică a soluției. În general, esența procesului este redusă la descompunerea apei.

Intră în laborator
Printre metodele de laborator, metoda de tratament termic a devenit larg răspândită:
- peroxizi;
- săruri ale acizilor care conțin oxigen.
La temperaturi ridicate se descompun cu eliberarea de oxigen gazos. Procesul este cel mai adesea catalizat de oxid de mangan (IV). Oxigenul este colectat prin deplasarea apei și este descoperit - de o rază afundă. După cum știți, într-o atmosferă de oxigen, flacăra se aprinde foarte puternic.
O altă substanță folosită pentru a produce oxigen în lecțiile de chimie școlară este peroxidul de hidrogen. Chiar și soluția de 3% sub influența catalizatorului se descompune instantaneu prin eliberarea gazului pur. Trebuie doar să fie colectată. Catalizatorul este același - oxid de mangan MnO2.
Printre sărurile cel mai des folosite sunt:
- sare de bertonturi sau clorat de potasiu;
- permanganat de potasiu sau mangan.
Pentru a descrie procesul, putem da ecuația. Oxigenul este suficient pentru nevoile de laborator și de cercetare:
2KClO3 = 2KCI + 302uarr-.
Modificări alotropice ale oxigenului
Există o modificare alotropică pe care o are oxigenul. Formula pentru acest compus este O3, se numește ozon. Este un gaz care se formează în condiții naturale sub influența descărcărilor ultraviolete și a fulgerului asupra oxigenului aerului. Spre deosebire de O în sine2, ozonul are un miros plăcut de prospețime, care este simțit în aer după ploaie cu fulgere și tunete.
Diferența dintre oxigen și ozon nu este numai numărul de atomi din moleculă, ci și structura rețelei cristaline. Din punct de vedere chimic, ozonul este un oxidant chiar mai puternic.
Oxigenul este o componentă a aerului
Distribuția oxigenului în natură este foarte mare. Oxigenul se găsește în:
- roci și minerale;
- apă sărată și proaspătă;
- sol;
- plante și animale;
- aer, inclusiv atmosfera superioară.
Este evident că ocupă toate cochiliile Pământului - litosfera, hidrosfera, atmosfera și biosfera. Este deosebit de important conținutul său în aer. La urma urmei, acest factor permite formelor de viață, inclusiv omului, să existe pe planeta noastră.

Compoziția aerului pe care îl respirăm este extrem de eterogenă. Acesta include atât componentele constante, cât și variabilele. Pentru neschimbate și întotdeauna prezente sunt:
- Dioxid de carbon;
- oxigen;
- azot;
- gaze nobile.
Variabilele pot include vapori de apă și de particule de praf gaze de eșapament (străine, produsele de combustie, putrezire, etc.), polenul plantelor, bacterii, fungi și altele.
Importanța oxigenului în natură
Este foarte important cât de mult oxigen este conținut în natură. Se stie ca pe unii sateliti de planete mari (Jupiter, Saturn) s-au descoperit urme de gaz, dar nu exista o viata evidenta acolo. Pământul nostru are un număr suficient din acesta, care, în combinație cu apa, face posibilă existența tuturor organismelor vii.
În plus față de a fi un participant activ în respirație, oxigenul continuă să facă nenumărate reacții de oxidare, care eliberează energie pentru viață.
Principalii furnizori ai acestui gaz unic în natură sunt plantele verzi și câteva tipuri de bacterii. Datorită acestora, un echilibru constant de oxigen și dioxid de carbon este menținut. În plus, ozonul construiește un ecran de protecție pe întregul Pământ, care nu permite penetrarea unor cantități mari de radiații ultraviolete care o distrug.

Doar câteva tipuri de organisme anaerobe (bacterii, ciuperci) pot trăi în afara atmosferei de oxigen. Cu toate acestea, există mult mai puțini dintre aceștia decât cei care au nevoie foarte mult.
Utilizarea oxigenului și a ozonului în industrie
Principalele domenii de utilizare a modificărilor alotrope de oxigen în industrie sunt următoarele.
- Metalurgie (pentru sudarea si taierea metalelor).
- Medicina.
- Agricultura.
- Ca combustibil pentru rachete.
- Sinteza multor compuși chimici, inclusiv explozivi.
- Purificarea și dezinfectarea apei.
Este dificil să numim chiar un singur proces în care acest mare gaz, o substanță unică - oxigenul nu participă.
 Molecule de hidrogen: diametru, formulă, structură. Care este masa moleculei de hidrogen?
Molecule de hidrogen: diametru, formulă, structură. Care este masa moleculei de hidrogen? Care este valența sulfului? Posibile valențe de sulf
Care este valența sulfului? Posibile valențe de sulf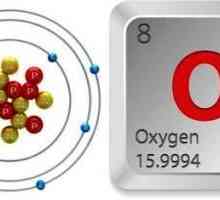 Modificări alotropice ale oxigenului: caracteristică și valoare comparativă
Modificări alotropice ale oxigenului: caracteristică și valoare comparativă Masa moleculară a oxigenului. Care este masa molară de oxigen?
Masa moleculară a oxigenului. Care este masa molară de oxigen?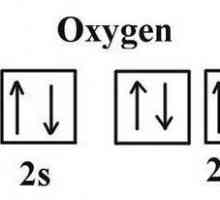 Care este valența de oxigen în compuși?
Care este valența de oxigen în compuși?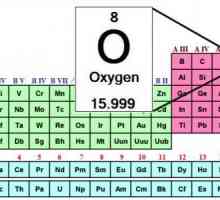 Formula de oxigen. Tabelul periodic al lui Mendeleev - oxigen
Formula de oxigen. Tabelul periodic al lui Mendeleev - oxigen Ozonul (element chimic): proprietăți, formulă, desemnare
Ozonul (element chimic): proprietăți, formulă, desemnare Nucleul atomic. Descoperirea unor secrete
Nucleul atomic. Descoperirea unor secrete Cum se compune o ecuație chimică: reguli, exemple. Înregistrarea reacției chimice
Cum se compune o ecuație chimică: reguli, exemple. Înregistrarea reacției chimice Substanțe anorganice
Substanțe anorganice Care este natura oxizilor
Care este natura oxizilor Să vorbim despre cum să găsim protoni, neutroni și electroni
Să vorbim despre cum să găsim protoni, neutroni și electroni Cum se determină compoziția calitativă și cantitativă a materiei
Cum se determină compoziția calitativă și cantitativă a materiei Cele mai ușoare gaze. Caracteristici ale hidrogenului, oxigenului și azotului
Cele mai ușoare gaze. Caracteristici ale hidrogenului, oxigenului și azotului Găsirea oxigenului în natură. Ciclul oxigenului în natură
Găsirea oxigenului în natură. Ciclul oxigenului în natură Non-metalele sunt ...? Proprietăți ale metalelor
Non-metalele sunt ...? Proprietăți ale metalelor Cum se găsește masa molară
Cum se găsește masa molară Substanțe simple
Substanțe simple Caracteristici generale și aplicarea oxigenului
Caracteristici generale și aplicarea oxigenului Proprietățile chimice și fizice, aplicarea și producerea oxigenului
Proprietățile chimice și fizice, aplicarea și producerea oxigenului Oxigenul prezintă o stare de oxidare pozitivă în legătură cu ce?
Oxigenul prezintă o stare de oxidare pozitivă în legătură cu ce?
 Care este valența sulfului? Posibile valențe de sulf
Care este valența sulfului? Posibile valențe de sulf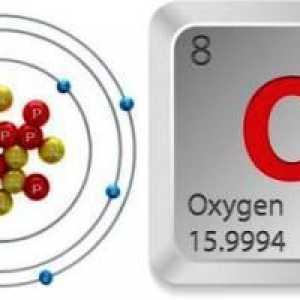 Modificări alotropice ale oxigenului: caracteristică și valoare comparativă
Modificări alotropice ale oxigenului: caracteristică și valoare comparativă Masa moleculară a oxigenului. Care este masa molară de oxigen?
Masa moleculară a oxigenului. Care este masa molară de oxigen?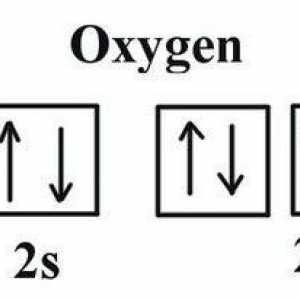 Care este valența de oxigen în compuși?
Care este valența de oxigen în compuși? Formula de oxigen. Tabelul periodic al lui Mendeleev - oxigen
Formula de oxigen. Tabelul periodic al lui Mendeleev - oxigen Ozonul (element chimic): proprietăți, formulă, desemnare
Ozonul (element chimic): proprietăți, formulă, desemnare Cum se compune o ecuație chimică: reguli, exemple. Înregistrarea reacției chimice
Cum se compune o ecuație chimică: reguli, exemple. Înregistrarea reacției chimice Care este natura oxizilor
Care este natura oxizilor