Proprietățile fizice ale acidului acetic, formula
O sticla tipica de otet alimentar, care poate fi gasita in bucataria oricărei gospodine, are multe alte acizi și vitamine. Adăugând câteva picături de produs la alimente gătite, salatele provoacă o îmbunătățire naturală a gustului. Dar puțini dintre noi s-au gândit cu adevărat la proprietățile și la scările reale ale aplicării componentei principale -
conținut
Ce este această substanță?
Formula acidului acetic CH3COOH, care o raportează la un număr de acizi carboxilici grași. Prezența unei grupări carboxil (COOH) se referă la acizi monobazici. Substanța se găsește pe glob în formă organică și se obține sintetic în laboratoare. Acidul este cel mai simplu, dar nu mai puțin important reprezentant al seriei sale. Ușor solubil în apă, higroscopic.

Proprietățile fizice ale acidului acetic și densitatea variază în funcție de regimul de temperatură. La temperatura camerei, în 20 de minutedespreAcidul C este în stare lichidă, are o densitate de 1,05 g / cm3. Are un miros specific și un gust acru. Soluția substanței fără impurități se întărește și trece în cristale la o temperatură sub 17 ° CdespreC. Procesul de acid acetic la fierbere începe la o temperatură de peste 117 ° CdespreC. Gruparea metil (CH3) cu formula acidului acetic se obține prin interacțiunea alcoolilor cu oxigenul: fermentarea substanțelor alcoolice și a carbohidraților, sourarea vinurilor.
Un pic de istorie
Descoperirea oțetului a fost una dintre primele dintr-o serie de acizi și a fost efectuată în etape. Inițial, acidul acetic a început să fie extras prin distilarea oamenilor de știință arabi din secolul al VIII-lea. Totuși, chiar și în Roma antică, această substanță, derivată din vinul acru, a fost folosită ca un sos universal. Numele însuși din greaca veche este tradus ca "acru". În secolul al XVII-lea, oamenii de știință din Europa au reușit să extragă o substanță pură a materiei. În acel moment, ei au derivat formula și au găsit o abilitate neobișnuită - Acidul acetic în stare de vapori a fost aprins de focul albastru.
Până în secolul al XIX-lea, oamenii de știință au descoperit prezența acidului acetic numai în formă organică - ca parte a compușilor de săruri și eteri. În compoziția plantelor și a fructelor lor: mere, struguri. În corpul oamenilor și al animalelor: secreții de sudoare, bilă. La începutul secolului XX, oamenii de știință ruși au extras accidental aldehida acetică din reacția acetilenei cu oxid de mercur. Pentru astăzi, consumul de acid acetic este atât de mare încât producția sa principală are loc numai într-o manieră sintetică pe o scară uriașă.
Metode de extracție
Acidul acetic de formă pură sau cu prezența impurităților în soluție depinde de metoda de extracție. Acidul acetic alimentar este obținut printr-o metodă biochimică în procesul de fermentare cu etanol. În industrie, mai multe moduri de extragere a acidului sunt izolate. De regulă, reacțiile sunt însoțite de o temperatură ridicată și de prezența catalizatorilor:
- Metanol în reacție cu carbon (carbonilarea).
- Oxidarea fracțiunii de ulei cu oxigen.
- Piroliza lemnului.
- Oxidarea acetaldehidei cu oxigen.

Metoda industrială este mai eficientă și mai economică decât cea biochimică. Datorită metodei industriale, volumul producției de acid acetic în secolele 20 și 21 a crescut de sute de ori, comparativ cu secolul al XIX-lea. Pentru astăzi, sinteza acidului acetic prin carbonilarea metanolului reprezintă mai mult de 50% din volumul total produs.
Proprietățile fizice ale acidului acetic și efectul acestuia asupra indicatorului
În stare lichidă, acidul acetic este incolor. Nivelul de aciditate al pH-ului 2,4 se verifică cu ușurință cu ajutorul unui test de greutate. Acid acetic atunci când atinge indicatorul pete roșu. Proprietățile fizice ale acidului acetic variază vizual. Atunci când temperatura scade sub 16despreC, substanța are o formă solidă și seamănă cu mici cristale de gheață. Se dizolvă ușor în apă și interacționează cu o gamă largă de solvenți, cu excepția hidrogenului sulfurat. Acidul acetic reduce volumul total al lichidului atunci când este diluat cu apă. Descrieți independent proprietățile fizice ale acidului acetic, culoarea și consistența acestuia, pe care le observați în imaginea de mai jos.

Substanța se aprinde la o temperatură de 455 ° CdespreOdată cu eliberarea căldurii la 876 kJ / mol. Masa molară este de 60,05 g / mol. Proprietățile fizice ale acidului acetic ca un electrolitic în reacții sunt slabe. Permitivitatea este de 6,15 la temperatura camerei. Presiunea, ca și densitatea, - valoarea fizică variabilă a acidului acetic. La o presiune de 40 mm. Hg. Art. și temperatura 42despreC va începe procesul de fierbere. Dar deja la o presiune de 100 mm. Hg. Art. Încălzirea are loc numai la 62 de anidespreS.
Proprietăți chimice
Reacționând cu metale și oxizi, substanța prezintă proprietățile sale acide. Prin dizolvarea completă a compușilor mai complexe, acidul formează săruri, numite acetați: magneziu, plumb, potasiu, etc. Valoarea acidului pK este de 4,75.

Când interacționează cu gaze, intră în oțet substituție cu deplasarea ulterioară și formarea unor acizi mai complexe: cloracetic, iodacetic. Prin dizolvarea în apă, acidul disociază cu eliberarea ionilor de acetat și a protonilor de hidrogen. Gradul de disociere este de 0,4%.
Proprietățile fizice și chimice ale moleculelor de acid acetic într-o formă cristalină creează diameri pe legăturile de hidrogen. De asemenea, proprietățile sale sunt necesare atunci când se creează acizi grași mai complexe, steroizi și biosinteza sterolului.
Teste de laborator
Detectarea acidului acetic în soluție se datorează identificării proprietăților sale fizice, de exemplu mirosului. Este suficient să adăugați un acid mai puternic la soluție, care va începe să înlocuiască sărurile de oțet cu eliberarea vaporilor. Prin distilarea în laborator a CH3COONa și H2SO4 este posibil să se obțină acid acetic în stare uscată.
Vom desena experiența din programul de școală privind chimia clasei a VIII-a. Proprietățile fizice ale acidului acetic demonstrează clar reacția chimică a dizolvării. Este suficient să adăugați oxid de cupru în soluție la substanță și să-l încălzi ușor. Oxidul se dizolvă complet, făcând o soluție de culoare albăstrui.
agenți derivatele
Reacțiile calitative ale substanței cu multe soluții formează: esteri, amide și săruri. Cu toate acestea, în timpul fabricării altor substanțe, cerințele privind proprietățile fizice ale acidului acetic rămân ridicate. Ar trebui să aibă întotdeauna un grad ridicat de dizolvare și, prin urmare, să nu aibă impurități terțe.
În funcție de concentrația acidului acetic al soluției apoase, se izolează un număr de derivați ai acestuia. Concentrația substanței mai mult de 96% are denumirea - acid acetic glacial. Acidul acetic în proporție de 70-80% poate fi achiziționat în magazinele de bacanie, unde va fi numit - esența acetică. Oțetul de masă are o concentrație de 3-9%. 
Acid acetic și viața de zi cu zi
În plus față de caracteristicile alimentare, acidul acetic are o serie de proprietăți fizice, la care omenirea și-a găsit aplicația în viața de zi cu zi. O soluție a unei substanțe cu concentrație scăzută îndepărtează cu ușurință placa din produsele metalice, suprafața oglinzilor și a ferestrelor. Abilitatea de a absorbi umezeala joacă și ea bine. Oțetul îndepărtează bine mirosurile în încăperile dură, îndepărtează petele de legume și fructe pe haine.
După cum sa dovedit, proprietatea fizică a acidului acetic - pentru a îndepărta grăsimea de pe suprafață - pot găsi aplicații în medicina populară și cosmetologie. O soluție slabă de oțet alimentar este tratată cu păr pentru a le da strălucire. Substanța este utilizată pe scară largă pentru a trata răcelile, pentru a elimina verucile și ciupercile pielii. Folosirea oțetului ca parte a ambalajelor cosmetice pentru combaterea celulitei câștigă impuls.
Utilizare în producție
În compușii sărurilor și al altor substanțe complexe, acidul acetic este un element indispensabil:
- Industria farmaceutică. Pentru a crea: unguente de aspirină, antiseptică și antibacteriană, fenacetin.
- Fabricarea fibrelor sintetice. Filme neinflamabile, acetat de celuloză.
- Industria alimentară. Pentru conservarea cu succes, prepararea marinelor și sosurilor, ca aditiv alimentar E260.
- Industria textilă. Face parte din coloranți.
- Fabricarea produselor cosmetice și igienice. Uleiuri aromatice, cremă pentru îmbunătățirea tonusului pielii.
- Făcând mordanți. Folosit ca insecticid și mordant împotriva buruienilor.
- Fabricarea lacurilor. Solvenți tehnici, producția de acetonă.

Producția de acid acetic crește anual. Astăzi volumul său în lume este de peste 400 mii tone pe lună. Acidul este transportat în tancuri puternice din oțel. Depozitarea în recipiente din plastic în numeroase instalații de producție în legătură cu activitatea fizică și chimică ridicată a acidului acetic este interzisă sau limitată la o perioadă de câteva luni.
siguranță
Acidul acetic de concentrație ridicată are un grad de aprindere 3 și eliberează vapori toxici. Se recomandă folosirea măștilor de gaz speciale și a altor echipamente de protecție individuală în timpul lucrului cu acid. O doză letală pentru corpul uman de la 20 ml. La momentul ingerării, acidul arde mai întâi membrana mucoasă și apoi afectează celelalte organe. În astfel de cazuri, este necesară o spitalizare imediată.
Dupa obtinerea de acid pe zonele expuse ale pielii, se recomanda sa se spala imediat cu apa curgatoare. Suprafața arsă cu acid poate provoca necroza tisulară, care necesită, de asemenea, spitalizare.
Fapte interesante
Oamenii de stiinta de fiziologie au descoperit ca o persoana nu este deloc obligata sa ia acid acetic - puteti face fara aditivi alimentari. Dar persoanele cu intoleranță acută, precum și cu probleme de stomac, substanța este contraindicată.

Acidul acetic este utilizat în tipărirea cărților.
Substanța a fost găsită în cantități mici în miere, banane și grâu.
Răcirea acidului acetic și a pompei cu un recipient, vă puteți observa coagularea ascuțită.
O mică concentrație de acid acetic poate reduce simptomele durerii de la o mușcătură de insecte, precum și arsuri minore.
Admiterea la produsele alimentare cu conținut scăzut de acid acetic reduce nivelul colesterolului din organism. Substanța stabilizează nivelul zahărului la diabetici bine.
Utilizarea alimentelor pe bază de proteine și carbohidrați împreună cu o cantitate mică de acid acetic mărește digestibilitatea organismului.
Dacă mâncarea este sărată, adăugați doar câteva picături de oțet pentru a netezi săratul.
În sfârșit
Mileniile utilizării acidului acetic au condus la faptul că proprietățile sale fizice și chimice își găsesc aplicarea la fiecare pas. Sute de posibile reacții, mii de substanțe utile, datorită cărora omenirea merge mai departe. Principalul lucru este să cunoaștem toate caracteristicile acidului acetic, calitățile sale pozitive și negative.
Nu uitați despre beneficii, dar amintiți-vă întotdeauna ce vătămare poate provoca manipularea neatentă a acidului acetic de concentrație ridicată. Prin pericolul său, se află lângă acidul clorhidric și acidul sulfuric. Amintiți-vă întotdeauna despre siguranță atunci când utilizați acid. Corectați și diluați cu atenție esența cu apă.
 Sfaturi privind modul de diluare a acidului acetic 70%
Sfaturi privind modul de diluare a acidului acetic 70% Acizi carboxilici: proprietăți fizice. Săruri ale acizilor carboxilici
Acizi carboxilici: proprietăți fizice. Săruri ale acizilor carboxilici Acid oxalic
Acid oxalic Acetat de potasiu
Acetat de potasiu Formula acidului boric în chimie
Formula acidului boric în chimie Acid acetic
Acid acetic Acid benzoic
Acid benzoic Acid carboxilic
Acid carboxilic Acid malic
Acid malic Esteri: caracteristici generale și aplicare
Esteri: caracteristici generale și aplicare Acidul piruvic și utilizarea acestuia ca mijloc de peeling
Acidul piruvic și utilizarea acestuia ca mijloc de peeling Anhidrida acetică: proprietăți, producție și aplicare
Anhidrida acetică: proprietăți, producție și aplicare Acid uleios: proprietăți și aplicare
Acid uleios: proprietăți și aplicare Prepararea acidului acetic
Prepararea acidului acetic Acid propanoic. Proprietăți fizice și chimice. Aplicare, siguranță la locul de muncă.
Acid propanoic. Proprietăți fizice și chimice. Aplicare, siguranță la locul de muncă. O aldehidă acetică. Proprietăți fizice și termice. Pregătirea și aplicarea
O aldehidă acetică. Proprietăți fizice și termice. Pregătirea și aplicarea Acid adipic. Proprietăți și aplicații
Acid adipic. Proprietăți și aplicații Acid palmitic. Proprietăți, producție, aplicare
Acid palmitic. Proprietăți, producție, aplicare Izomerismul și nomenclatorul acizilor carboxilici, structura și descrierea
Izomerismul și nomenclatorul acizilor carboxilici, structura și descrierea Compuși care conțin oxigen: exemple, proprietăți, formule
Compuși care conțin oxigen: exemple, proprietăți, formule Acid etanic. Proprietăți fizice, producție și utilizare
Acid etanic. Proprietăți fizice, producție și utilizare
 Acizi carboxilici: proprietăți fizice. Săruri ale acizilor carboxilici
Acizi carboxilici: proprietăți fizice. Săruri ale acizilor carboxilici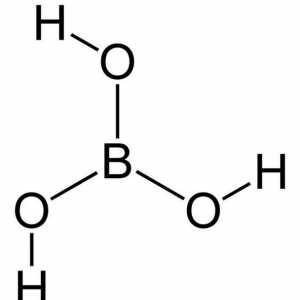 Formula acidului boric în chimie
Formula acidului boric în chimie