Ozonul este un gaz de culoare albastră. Proprietăți și aplicarea gazului. Ozonul din atmosferă
Ozonul este un gaz. Spre deosebire de multe altele, nu este transparent, dar are o culoare caracteristică și chiar un miros. Este prezentă în atmosfera noastră și este una dintre cele mai importante componente ale acesteia. Care este densitatea ozonului, a masei sale și a altor proprietăți? Care este rolul său în viața planetei?
conținut
Gaz albastru
În chimie, ozonul nu are un loc separat în tabelul periodic. Toate pentru că el nu este un element. Ozonul este o modificare alotropică sau o variație a oxigenului. Ca și în O2, molecula sa constă doar din atomi de oxigen, dar nu are două, ci trei. Prin urmare, formula sa chimică arată ca O3.

Ozonul este un gaz de culoare albastră. Are miros accentuat, resimțit de clor, dacă concentrația este prea mare. Îți amintești mirosul de prospețime din ploaie? Acesta este ozonul. Datorită acestei proprietăți, și-a luat numele, deoarece din limba greacă veche "ozon" - "miroase".
atomii polari molecula Gas acestea sunt conectate la un unghi de 116,78 °. Ozonul este format atunci când un atom de oxigen liber este adăugat la molecula de O2. Acest lucru se întâmplă în timpul diferitelor reacții, cum ar fi oxidarea fosforului, electroeroziune sau descompunerea peroxizi, în care atomii de oxigen și îndepărtat.
Proprietăți ale ozonului
În condiții normale, ozonul există în forma de gaz cu o greutate moleculară de aproape 48 g / mol. Este o diamagnet, adică nu poate atrage la un magnet, la fel ca argintul, aurul sau azotul. Densitatea de ozon este de 2.1445 g / dmsup3.
În stare solidă, ozonul dobândește o culoare alb-negru, în stare lichidă este indigo, aproape de purpuriu. Punctul de fierbere este de 111,8 grade Celsius. La o temperatură de zero grade, se dizolvă în apă (numai în apă pură) de zece ori mai bună decât oxigenul. Se amestecă perfect cu lichid metan, azot, fluor, argon și în anumite condiții cu oxigen.

Sub acțiunea unui număr de catalizatori este ușor de oxidat, eliberând atomii de oxigen liber. Conectarea cu el, imediat aprins. Substanța este capabilă să oxideze aproape toate metalele. Doar platina și aurul nu se pretează acțiunii sale. Distruge diferiți compuși organici și aromatici. La contactul cu amoniacul, formează nitrit de amoniu, distrug legăturile duble de carbon.
Fiind prezent în atmosferă în concentrații mari, ozonul se descompune spontan. În acest caz, căldura este eliberată și se formează o moleculă O2. Cu cât concentrația este mai mare, cu atât este mai puternică reacția de eliberare a căldurii. Cu un conținut de ozon mai mare de 10%, este însoțit de o explozie. Având în vedere creșterea temperaturii și scăderea presiunii sau contactul cu substanțele organice, descompunerea lui O3 este mai rapidă.
Istoria descoperirii
În chimie, ozonul nu era cunoscut decât în secolul al XVIII-lea. A fost descoperită în 1785 datorită mirosului pe care fizicianul Van Marum la auzit lângă mașina electrostatică de lucru. Alți 50 de ani după aceea, gazul nu a fost inclus în experimente și cercetări științifice.
Cercetătorul Christian Schonbein în 1840 a studiat oxidarea fosforului alb. În timpul experimentelor, el a reușit să identifice o substanță necunoscută, pe care o numește "ozon". Chimistul a preluat studiul proprietăților sale și a descris modalități de obținere a gazului nou descoperit.
În curând, alți cercetători s-au alăturat cercetării substanței. Renumitul fizician Nikola Tesla a construit chiar primul în istorie generator de ozon. Utilizarea industrială a O3 a început la sfârșitul secolului al XIX-lea odată cu apariția primelor instalații de alimentare cu apă potabilă a locuințelor. Substanța a fost utilizată pentru dezinfecție.

Ozonul din atmosferă
Pământul nostru este înconjurat de o coajă invizibilă a aerului - atmosfera. Fără ea, viața de pe planetă ar fi imposibilă. Componentele aerului atmosferic: oxigen, ozon, azot, hidrogen, metan și alte gaze.
Ozonul însăși nu există și provine numai din reacțiile chimice. Aproape de suprafața Pământului, se formează datorită descărcărilor electrice ale fulgerului în timpul unei furtuni. Modul nefiresc apare din cauza emisiilor de gaze de eșapament, plante, gaze, efectul centralelor termice.

Ozonul straturilor inferioare ale atmosferei se numește suprafață sau troposferică. Există, de asemenea, un strat stratosferic. Apare sub acțiunea radiațiilor ultraviolete provenite de la Soare. Se formează la o distanță de 19-20 de kilometri deasupra suprafeței planetei și se întinde la o altitudine de 25-30 kilometri.
Stratospheric O3 formează stratul de ozon al planetei, care îl protejează de radiațiile solare puternice. Acesta absoarbe aproximativ 98% din radiațiile ultraviolete cu o lungime de undă suficientă pentru apariția cancerului și a arsurilor.
Aplicarea substanței
Ozonul este un excelent oxidant și distrugător. Această proprietate a fost mult timp folosit pentru purificarea apei potabile. Substanța are un efect dăunător asupra bacteriilor și a virușilor periculoase pentru oameni și se transformă în oxigen inofensiv în timpul oxidării.
Este capabil să ucidă chiar și organismele rezistente la clor. În plus, se utilizează pentru purificarea apelor uzate de produse petroliere dăunătoare mediului, sulfuri, fenoli etc. Astfel de practici sunt predominante în special în SUA și în unele țări europene.
Ozonul este utilizat în medicină pentru a dezinfecta unelte, în industrie cu ajutorul său, hârtie albă, uleiuri curate, obține substanțe diferite. Utilizarea lui O3 pentru curățarea aerului, apei și a unei încăperi se numește ozonare.

Ozonul și omul
În ciuda tuturor proprietăților sale utile, ozonul poate fi periculos pentru oameni. Dacă există mai mult gaz în aer decât o persoană poate tolera, otrăvirea nu poate fi evitată. În Rusia, norma admisibilă este de 0,1 μg / l.
Când această limită este depășită, apar semne tipice de otrăvire chimică, cum ar fi dureri de cap, iritații ale membranelor mucoase, amețeli. Ozonul reduce rezistența organismului la infecțiile transmise prin tractul respirator și reduce tensiunea arterială. Dacă concentrația de gaz este mai mare de 8-9 μg / l, este posibilă edemul pulmonar și chiar moartea.
În același timp, este ușor să recunoști ozonul în aer. Mirosul "prospețimii", clorului sau "racului" (așa cum susținea Mendeleev) este clar audibil chiar și cu un conținut scăzut de materie.
 Terapia cu ozon. Numai recenzii
Terapia cu ozon. Numai recenzii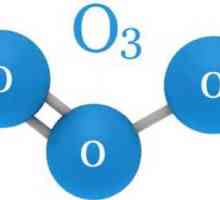 Molecule de ozon: structură, formulă, model. Cum arată o moleculă de ozon?
Molecule de ozon: structură, formulă, model. Cum arată o moleculă de ozon? Formula chimică a ozonului. Formula structurală a ozonului
Formula chimică a ozonului. Formula structurală a ozonului De unde a provenit ozonul și rolul său în natură
De unde a provenit ozonul și rolul său în natură Dozatoare de ozon. Caracteristicile aplicației
Dozatoare de ozon. Caracteristicile aplicației Terapia cu ozon. Feedback asupra unei noi metode de tratament
Terapia cu ozon. Feedback asupra unei noi metode de tratament Cum funcționează carburatorul `Ozone`?
Cum funcționează carburatorul `Ozone`?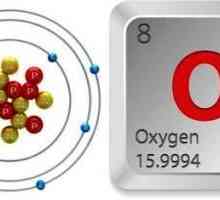 Modificări alotropice ale oxigenului: caracteristică și valoare comparativă
Modificări alotropice ale oxigenului: caracteristică și valoare comparativă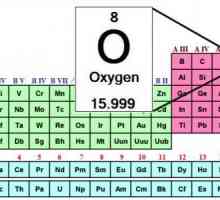 Formula de oxigen. Tabelul periodic al lui Mendeleev - oxigen
Formula de oxigen. Tabelul periodic al lui Mendeleev - oxigen Ozonoterapie pentru pierderea în greutate: o modalitate ușoară de a scăpa de kilogramele în plus
Ozonoterapie pentru pierderea în greutate: o modalitate ușoară de a scăpa de kilogramele în plus Unde este stratul de ozon? Care este stratul de ozon și de ce este distrugerea acestuia?
Unde este stratul de ozon? Care este stratul de ozon și de ce este distrugerea acestuia? Ozonul (element chimic): proprietăți, formulă, desemnare
Ozonul (element chimic): proprietăți, formulă, desemnare Oxigenul este ... Formula de oxigen. O moleculă de oxigen
Oxigenul este ... Formula de oxigen. O moleculă de oxigen Ce este ozonul? Proprietățile și influența sa asupra activității umane
Ce este ozonul? Proprietățile și influența sa asupra activității umane Care este gradul de oxidare a oxigenului? Valence și gradul de oxidare a oxigenului
Care este gradul de oxidare a oxigenului? Valence și gradul de oxidare a oxigenului Are ozonoterapia contraindicații?
Are ozonoterapia contraindicații? Generatoare de ozon: avantaje și caracteristici
Generatoare de ozon: avantaje și caracteristici Alotropia este ... Definirea conceptului și a cauzei
Alotropia este ... Definirea conceptului și a cauzei Găurile de ozon - problema timpului nostru
Găurile de ozon - problema timpului nostru Ozonoterapia în cosmetologie este o alternativă la procedurile chirurgicale
Ozonoterapia în cosmetologie este o alternativă la procedurile chirurgicale Sistem de curățare a bazinelor
Sistem de curățare a bazinelor
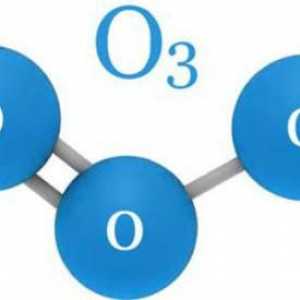 Molecule de ozon: structură, formulă, model. Cum arată o moleculă de ozon?
Molecule de ozon: structură, formulă, model. Cum arată o moleculă de ozon? Formula chimică a ozonului. Formula structurală a ozonului
Formula chimică a ozonului. Formula structurală a ozonului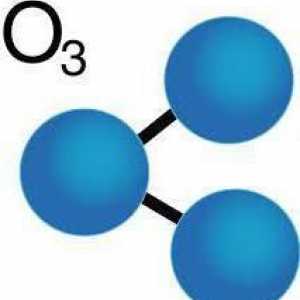 De unde a provenit ozonul și rolul său în natură
De unde a provenit ozonul și rolul său în natură Dozatoare de ozon. Caracteristicile aplicației
Dozatoare de ozon. Caracteristicile aplicației Terapia cu ozon. Feedback asupra unei noi metode de tratament
Terapia cu ozon. Feedback asupra unei noi metode de tratament Cum funcționează carburatorul `Ozone`?
Cum funcționează carburatorul `Ozone`?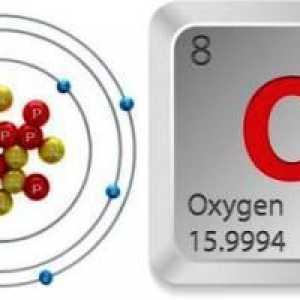 Modificări alotropice ale oxigenului: caracteristică și valoare comparativă
Modificări alotropice ale oxigenului: caracteristică și valoare comparativă Formula de oxigen. Tabelul periodic al lui Mendeleev - oxigen
Formula de oxigen. Tabelul periodic al lui Mendeleev - oxigen Unde este stratul de ozon? Care este stratul de ozon și de ce este distrugerea acestuia?
Unde este stratul de ozon? Care este stratul de ozon și de ce este distrugerea acestuia?