Cum sunt situate particulele în solide, lichide și gaze?
Acest material nu numai că povestește cum sunt aranjate particulele în solide, dar și cum se mișcă în gaze sau în lichide. Tipurile de laturi cristaline în diverse substanțe vor fi de asemenea descrise.
conținut
- Starea agregată
- Caracteristici fluide
- Schimbarea stării substanțelor
- Ce este un corp solid? cum se comportă microparticulele în ea?
- Fizica și structura posibilă a unui solid
- Particulele și amplasarea lor într-un solid
- Cristale singulare și policristaline
- Amorf: un caz special
- Exemple de substanțe amorfe
- Rezultatele. concluzie

Starea agregată
Există anumite standarde care indică prezența a trei stări agregate tipice, și anume: solid lichid și gaz.
Definiți componentele pentru fiecare stare agregată.
- Solidul este practic stabil în volum și formă. Ultima schimbare este extrem de problematică fără costuri suplimentare pentru energie.
- Lichidul poate schimba cu ușurință forma, dar își păstrează încă volumul.
- Substanțele gazoase nu păstrează forma sau volumul.
Principalul criteriu prin care se determină starea agregată este localizarea moleculelor și modurile în care acestea se mișcă. În materie gazoasă, distanța minimă dintre moleculele individuale este mult mai mare decât ele însele. La rândul lor, moleculele substanțe lichide Nu se dispersează pe distanțe lungi în condițiile obișnuite pentru ei și își păstrează volumul. Particulele active din solide sunt aranjate într-o ordine strict definită, fiecare dintre ele, ca un ceas de pendul, se deplasează în jurul unui anumit punct din rețeaua cristalină. Aceasta conferă solidelor o rezistență și o rigiditate deosebită.
Prin urmare, în acest caz, cea mai relevantă întrebare este modul în care particulele active sunt situate în solide. În toate celelalte cazuri, atomii (moleculele) nu au o structură astfel ordonată.

Caracteristici fluide
Este necesar să se acorde o atenție deosebită faptului că lichidele sunt un fel de legătură intermediară între starea solidă a corpului și faza sa gazoasă. Astfel, pe măsură ce temperatura este scăzută, lichidul se solidifică și, atunci când crește mai mult decât punctul de fierbere al substanței, trece într-o stare gazoasă. Cu toate acestea, lichidul are caracteristici comune atât cu substanțe solide cât și gazoase. Deci, în 1860, remarcabilul om de știință domestice DI Mendeleyev a stabilit existența așa-numitei temperaturi critice - fierbere absolută. Aceasta este valoarea la care dispare granița subțire dintre gaz și materia în stare solidă.
Următorul criteriu, care combină două stări agregate vecine, este izotropia. În acest caz, proprietățile lor sunt identice în toate direcțiile. Cristalele, la rândul lor, sunt anisotropice. Ca și gazele, lichidele nu au o formă fixă și ocupă întregul volum al vasului în care sunt amplasate. Adică, au vâscozitate scăzută și fluiditate ridicată. Față unul față de celălalt, microparticulele lichide sau de gaz fac mișcări libere. Era de obicei faptul că în volumul ocupat de fluid nu există o mișcare moleculară ordonată. Astfel, lichidul și gazul s-au opus cristalelor. Dar, ca rezultat al studiilor ulterioare, sa demonstrat similitudinea între corpurile solide și cele lichide.
În faza lichidă, la o temperatură apropiată de solidificare, mișcarea termică seamănă cu mișcarea în solide. În acest caz, lichidul poate avea în continuare o anumită structură. Prin urmare, să dea un răspuns la această întrebare, deoarece particulele sunt aranjate în solide în lichide și gaze, putem spune că haotic, dezordonat în ultima mișcare a moleculelor. dar în moleculele solide ocupă, în majoritatea cazurilor, o poziție definită, fixă.
Fluidul este un fel de legătură intermediară. Și cu cât temperatura este mai apropiată de fierbere, cu atât mai multe molecule se mișcă în gaz. Dacă temperatura este mai aproape de trecerea la faza solidă, microparticulele încep să se miște din ce în ce mai ordonate.

Schimbarea stării substanțelor
Luați în considerare cel mai simplu exemplu de modificare a stării de apă. Gheața este o fază solidă de apă. Temperatura sa este sub zero. La o temperatură de zero, gheața începe să se topească și se transformă în apă. Acest lucru se datorează distrugerii rețelei cristaline: când este încălzită, particulele încep să se miște. Temperatura la care substanța modifică starea agregată se numește punctul de topire (în cazul nostru este 0 pentru apă). Rețineți că temperatura gheții va rămâne la un nivel până când se va topi complet. În acest caz, atomii sau moleculele lichidului se vor deplasa în același mod ca și în solide.
După aceea, vom continua să încălzim apa. Particulele încep să se miște mai intens, atâta timp cât substanța noastră nu ajunge la următorul punct de schimbare în starea agregată - punctul de fierbere. Un astfel de moment, are loc la legături de pauza dintre moleculele care formează prin accelerarea mișcării - ea devine apoi liber în natură, și este considerat de lichidul trece în faza gazoasă. Procesul de transformare a unei substanțe (apă) dintr-o fază lichidă într-o fază lichidă se numește fierbere.
Temperatura la care se fierbe apa se numeste punctul de fierbere. În cazul nostru, această valoare este egală cu 100 de grade Celsius (temperatura este dependentă de presiune, presiunea normală este o atmosferă). Notă: până când lichidul existent se transformă complet în abur, temperatura acestuia rămâne constantă.
De asemenea, este posibilă inversarea procesului de transfer de apă dintr-o stare gazoasă (vapori) către un lichid, care se numește condensare.
Apoi puteți observa procesul de înghețare - procesul de tranziție a unui lichid (apă) într-o formă solidă (starea inițială descrisă mai sus este gheața). Procesele descrise mai sus permit obținerea unui răspuns direct la modul în care particulele sunt aranjate în solide, în lichide și gaze. Poziția și starea moleculelor unei substanțe depind de starea ei agregată.

Ce este un corp solid? Cum se comportă microparticulele în ea?
Solid - această stare este mediul material, a cărui caracteristică distinctivă este de a menține o formă constantă și natura constantă a mișcării termice a microparticulelor care săvârșesc fluctuații minore. Corpurile pot fi într-o stare solidă, lichidă și gazoasă. Există, de asemenea, a patra stare, pe care oamenii de știință modernă tind să le atribuie numărului de agregate - aceasta este așa-numita plasmă.
Deci, în primul caz, orice substanță, de regulă, are o formă constantă, neschimbată, și acest lucru are un efect cheie asupra modului în care particulele sunt aranjate în solide. La nivel microscopic, se observă că atomii care formează substanța solidă, sunt conectate între ele prin legături chimice și sunt în rețeaua cristalină.
Dar există o excepție - substanțe amorfe care sunt într-o stare solidă, dar prezența unei rețele de cristal nu se poate lăuda. Din acest motiv putem răspunde la întrebarea cum sunt aranjate particulele în solide. Fizica în primul caz indică faptul că atomii sau moleculele se află în locurile de zăbrele. Dar în cel de-al doilea caz, nu există cu siguranță o astfel de comandă, și o astfel de substanță este mai mult ca un lichid.
Fizica și structura posibilă a unui solid
În acest caz, substanța tinde să-și mențină volumul și, desigur, forma. Adică, pentru a schimba ultimul, este necesar să depunem eforturi și nu contează dacă este vorba despre un obiect metalic, o bucată de plastic sau plastilină. Motivul constă în structura sa moleculară. Și mai precis, în interacțiunea moleculelor, din care constă corpul. În acest caz, acestea sunt situate cel mai îndeaproape. Acest aranjament de molecule are o natură recurentă. Acesta este motivul pentru care forțele de atracție reciprocă dintre fiecare dintre aceste componente sunt foarte mari.
Interacțiunea microparticulelor explică natura mișcării lor. Forma sau volumul unui astfel de corp solid este dificil de corectat într-o direcție sau alta. Particulele unui corp solid nu sunt capabile să se deplaseze aleatoriu pe întregul volum al unui solid, dar pot oscila doar în apropierea unui anumit punct din spațiu. Moleculele solidului fluctuează haotic în direcții diferite, dar se întâlnesc pe cele similare, care le readuc la starea inițială. Acesta este motivul pentru care particulele din solide sunt situate, de regulă, într-o ordine strict definită.

Particulele și amplasarea lor într-un solid
Corpurile solide pot fi de trei tipuri: cristaline, amorfe și compozite. Compoziția chimică influențează aranjarea particulelor în solide.
Solidele cristaline au o structură ordonată. Moleculele sau atomii lor formează o latură spațială cristalină de formă obișnuită. Astfel, un corp solid într-o stare cristalină are o latură de cristal definită, care la rândul ei definește anumite proprietăți fizice. Acesta este răspunsul la modul în care particulele sunt aranjate într-un solid.
Iată un exemplu: în urmă cu mulți ani în St. Petersburg în depozit pentru a deține stocul de butoane genial staniu alb, care, la temperaturi scăzute și-au pierdut luciul lor și de gri oțel alb. Butoanele au căzut într-o pulbere cenușie. "Ciuma de ciumă" - aceasta a fost numită această "boală", dar de fapt a fost o restructurare a structurii cristalului sub influența temperaturii scăzute. Tinutul în timpul tranziției de la soiul alb la gri se sfărâmă în pudră. Cristalele, la rândul lor, sunt împărțite în mono- și policristaline.

Cristale singulare și policristaline
Monocristalele (sare de masă) sunt cristale unice omogene reprezentate de o rețea de cristal continuă sub formă de poligoane regulate. Policristalele (nisip, zahăr, metale, pietre) sunt corpuri cristaline care au crescut de la cristale mici, aranjate haotic. În cristale, se observă un fenomen precum anizotropia.
Amorf: un caz special
corp amorfa (rășină, colofoniu, sticlă, chihlimbar) nu sunt clar ordinea strictă în aranjamentul particulelor. Acest caz neobișnuit, în ce ordine sunt particulele în solide. În acest caz, există fenomenul proprietăților fizice izotrope ale solidelor amorfe sunt aceleași în toate direcțiile. La temperaturi ridicate, ele devin ca un fluid vâscos, și la temperaturi joase - cum ar fi solide. Când forța externă prezintă simultan proprietăți elastice, adică atunci când fisura a lovit particule miniaturale ca solide, iar fluiditatea: temperatura la expunerea prelungită începe să curgă ca un lichid. Nu au temperaturi de topire și cristalizare definite. Când este încălzit, dedurizată corp amorf.
Exemple de substanțe amorfe
Luați, de exemplu, zahăr obișnuit și aflați aranjamentul particulelor în substanțe solide în diferite cazuri, pe exemplul său. În acest caz, același material poate să apară în formă cristalină sau amorfă. Dacă zahărul topit îngheață lent, moleculele formează chiar și rânduri - cristale (zahăr cu coajă sau zahăr granulat). Dacă zahărul topit, de exemplu, este turnat în apă rece, răcirea va avea loc foarte repede și particulele nu au timp să formeze rândurile corecte - topitura se va întări fără a se forma cristale. Deci, se dovedește bomboană de zahăr (acesta este zahărul non-cristalin).
Dar după un timp o astfel de substanță poate recristaliza, particulele sunt colectate în rândurile corecte. Dacă bomboana de zahăr se va așeza timp de câteva luni, va începe să fie acoperită cu un strat liber. Așa că apar pe suprafața cristalelor. Pentru zahăr, perioada va fi de câteva luni, iar pentru piatră - milioane de ani. Un exemplu unic este carbonul. Grafitul este un carbon cristalin, structura acestuia fiind stratificată. Un diamant este cel mai dur mineral pe pământ, capabil să taie sticlă și să taie pietre, este folosit pentru găurire și lustruire. În acest caz, substanța este un carbon, dar caracteristica este capacitatea de a forma diferite forme cristaline. Acesta este un alt răspuns la modul în care particulele sunt aranjate într-un solid.

Rezultatele. concluzie
Structura și aranjarea particulelor în solide depinde de tipul de substanță la care aparține substanța. Dacă substanța este cristalină, dispunerea microparticulelor va fi comandată. Structurile amorfe nu posedă o astfel de caracteristică. Dar compozitele pot face parte atât din primul, cât și din al doilea grup.
Într-un caz, lichidul se comportă similar solid (la temperatură joasă, care este apropiată de temperatura de cristalizare), dar poate duce și gazul (dacă crește). Prin urmare, în acest material de examinare, am examinat modul în care particulele sunt situate nu numai în solide, ci și în alte stări de materie agregate de materie.
 Vâscozitatea dinamică a unui lichid. Care este semnificația sa fizică și mecanică?
Vâscozitatea dinamică a unui lichid. Care este semnificația sa fizică și mecanică? Ce este aceasta: mișcarea termică? Cu ce noțiuni este legată?
Ce este aceasta: mișcarea termică? Cu ce noțiuni este legată? Difuzia într-un lichid: condiții de proces, exemple. Experimente cu lichide
Difuzia într-un lichid: condiții de proces, exemple. Experimente cu lichide Ce este un stat agregat? Starea agregată a materiei
Ce este un stat agregat? Starea agregată a materiei Solids: proprietăți, structură, densitate și exemple
Solids: proprietăți, structură, densitate și exemple Ce se numește substanță? Substanțe simple și complexe: concept
Ce se numește substanță? Substanțe simple și complexe: concept Substanțe gazoase: exemple și proprietăți
Substanțe gazoase: exemple și proprietăți Proprietățile lichidelor. Proprietățile fizice de bază ale unui lichid
Proprietățile lichidelor. Proprietățile fizice de bază ale unui lichid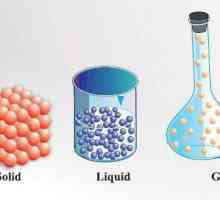 Proprietățile și structura corpurilor gazoase, lichide și solide
Proprietățile și structura corpurilor gazoase, lichide și solide Substanțe lichide și proprietățile acestora. Starea lichidă a materiei
Substanțe lichide și proprietățile acestora. Starea lichidă a materiei Amestecuri omogene: definirea conceptului, compoziție, exemple
Amestecuri omogene: definirea conceptului, compoziție, exemple Cum are loc trecerea unei substanțe dintr-o stare lichidă într-o stare solidă?
Cum are loc trecerea unei substanțe dintr-o stare lichidă într-o stare solidă? Tipuri de soluții. Tipuri de concentrație a soluției
Tipuri de soluții. Tipuri de concentrație a soluției Tipuri de laturi cristaline de diferite substanțe
Tipuri de laturi cristaline de diferite substanțe Starea agregată a materiei
Starea agregată a materiei Lichidele: exemple și proprietăți. Care sunt corpurile lichide
Lichidele: exemple și proprietăți. Care sunt corpurile lichide Despre ceea ce este difuzarea în fizică: definiția și exemplele interesante
Despre ceea ce este difuzarea în fizică: definiția și exemplele interesante Structura materiei
Structura materiei Corpurile amorfe. caracteristicile
Corpurile amorfe. caracteristicile Grinzile de cristal și principalele sale tipuri
Grinzile de cristal și principalele sale tipuri Perfect gaz
Perfect gaz
 Ce este aceasta: mișcarea termică? Cu ce noțiuni este legată?
Ce este aceasta: mișcarea termică? Cu ce noțiuni este legată? Difuzia într-un lichid: condiții de proces, exemple. Experimente cu lichide
Difuzia într-un lichid: condiții de proces, exemple. Experimente cu lichide Ce este un stat agregat? Starea agregată a materiei
Ce este un stat agregat? Starea agregată a materiei Solids: proprietăți, structură, densitate și exemple
Solids: proprietăți, structură, densitate și exemple Ce se numește substanță? Substanțe simple și complexe: concept
Ce se numește substanță? Substanțe simple și complexe: concept Substanțe gazoase: exemple și proprietăți
Substanțe gazoase: exemple și proprietăți Proprietățile lichidelor. Proprietățile fizice de bază ale unui lichid
Proprietățile lichidelor. Proprietățile fizice de bază ale unui lichid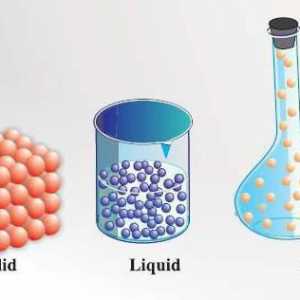 Proprietățile și structura corpurilor gazoase, lichide și solide
Proprietățile și structura corpurilor gazoase, lichide și solide Substanțe lichide și proprietățile acestora. Starea lichidă a materiei
Substanțe lichide și proprietățile acestora. Starea lichidă a materiei Amestecuri omogene: definirea conceptului, compoziție, exemple
Amestecuri omogene: definirea conceptului, compoziție, exemple