Molecule de ozon: structură, formulă, model. Cum arată o moleculă de ozon?
Expresia "stratul de ozon", care a devenit cunoscut în anii `70. în secolul trecut, de mult timp deja umplute pe margine. Cu toate acestea, foarte puțini oameni înțeleg cu adevărat ce înseamnă acest concept și cât de periculos este distrugerea stratului de ozon. Un mister și mai mare pentru mulți este structura moleculei de ozon și este direct legată de problemele stratului de ozon. Hai să aflăm mai multe despre ozon, structura sa și utilizarea acestei substanțe în industrie.
conținut
Ce este ozonul
Ozonul sau, după cum se mai numește și oxigenul activ, este un gaz de culoare azurie, cu un miros metalic ascuțit. 
Această substanță poate exista în toate cele trei stări agregate: gazoasă, solidă și lichidă.
În natură, ozonul se găsește numai sub formă de gaz, formând așa-numitul strat de ozon. Din cauza culorii sale azure, cerul pare albastru.
Cum arată o moleculă de ozon
Porecul său "ozon activ oxigen" se datorează asemănării sale cu oxigenul. Deci, principalul element chimic activ din aceste substanțe este oxigenul (O). Cu toate acestea, dacă există 2 atomi în molecula de oxigen, atunci molecula de ozon (formula - O3) constă din 3 atomi ai acestui element.
Datorită acestei structuri, proprietățile ozonului sunt similare oxigenului, dar sunt mai pronunțate. În special, cum ar fi O2, oh3 este cel mai puternic oxidant.
Cea mai importantă diferență între „sora“ de substanțe care în minte este vital pentru toată lumea, următoarele: Ozonul nu poate respira, este toxic dacă este inhalat, și este capabil de a provoca daune pulmonare sau chiar ucide o persoană. Mai mult, O3 Perfect pentru curățarea aerului de impurități toxice. Apropo, din cauza asta, după ploaie, este atât de ușor să respirați: ozonul oxidează substanțele nocive conținute în aer și este purificat.
Modelul moleculei de ozon (format din 3 atomi de oxigen) este un pic asemănător imaginii unghiului, iar dimensiunea sa este de 117 °. Această moleculă nu are electroni nepermani, deci este diamagnetic. În plus, are o polaritate, deși constă din atomi ai unui element. 
Doi atomi ai acestei molecule sunt strâns fixați împreună. Dar legătura cu al treilea este mai puțin fiabilă. Din acest motiv, molecula de ozon (modelul foto poate fi văzută mai jos) este foarte fragilă și se dezintegrează la scurt timp după formare. De regulă, pentru orice reacție de decădere O3 oxigenul este eliberat.
Din cauza instabilității ozonului, acesta nu poate fi recoltat și stocat și, de asemenea, transportat ca alte substanțe. Din acest motiv, producția sa este mai costisitoare decât alte substanțe.
Activitatea ridicată a moleculelor O3 permite ca această substanță să fie cel mai puternic oxidant, mai puternic decât oxigenul și mai sigur decât clorul.
Dacă molecula de ozon se prăbușește și O2, această reacție este întotdeauna însoțită de eliberarea de energie. În același timp, pentru ca procesul invers să aibă loc (formarea lui O3 din O2), este necesar să-l cheltuiască nu mai puțin. 
În starea gazoasă, molecula de ozon se descompune la o temperatură de 70 ° C. Dacă este crescut la 100 de grade sau mai mult, reacția va accelera foarte mult. De asemenea, accelerează perioada de degradare a moleculelor de ozon în prezența impurităților.
Proprietățile O3
În oricare dintre cele trei state ozonul este, rămâne albastru. Cu cât substanța este mai grea, cu atât mai intensă și mai întunecată este această umbră. 
Fiecare moleculă de ozon cântărește 48 g / mol. Este mai greu decât aerul, care ajută la separarea acestor substanțe între ele.
oh3 este capabil să oxideze aproape toate metalele și nemetalele (cu excepția aurului, iridiului și platinei).
De asemenea, această substanță poate participa la reacția de combustie, dar aceasta necesită o temperatură mai ridicată decât pentru O2.
Ozonul este capabil să se dizolve în H2Oh și Freon. În stare lichidă, poate fi amestecat cu oxigen lichid, azot, metan, argon, tetraclorocarbon și dioxid de carbon.
Cum se formează o moleculă de ozon
Molecule O3 sunt formate prin atașarea de atomi de oxigen liber la moleculele de oxigen. Ei, la rândul lor, apar datorită despicării altor molecule O2 din cauza impactului asupra lor a descărcărilor electrice, a razelor ultraviolete, a electronilor rapizi și a altor particule cu energie înaltă. Din acest motiv, mirosul specific de ozon poate fi simțit în apropierea aparatelor electrice aprinzand sau lămpi care emit lumina ultravioleta. 
La scară industrială, O3 izolate prin electricitate generatoare de ozon sau ozonizatoare. În aceste dispozitive, un curent electric de tensiune înaltă este trecut printr-un curent de gaze în care O2, ale căror atomi servesc drept "material de construcție" pentru ozon.
Uneori, oxigenul pur sau aerul obișnuit sunt lansate în aceste dispozitive. Calitatea ozonului rezultat depinde de puritatea produsului inițial. Deci, medicul O3, destinat tratamentului rănilor, este extras numai dintr-un O pur din punct de vedere chimic2.
Istoria descoperirii ozonului
Înțelegând cum arată molecula de ozon și modul în care se formează, merită să ne cunoaștem istoria acestei substanțe.
A fost prima dată sintetizată de cercetătorul olandez Martin Van Marum în a doua jumătate a secolului al XVIII-lea. Omul de știință a observat că după trecerea scântei electrice printr-un recipient cu aer, gazul din el și-a schimbat proprietățile. În același timp, Van Marum nu a înțeles că a izolat moleculele noii substanțe.
Dar colegul său german, numit Scheinbein, încearcă să descompună H2O pe H și O2, a atras atenția asupra alocării unui nou gaz cu un miros înțepător. Dupa ce a petrecut o mulțime de cercetare, un om de stiinta a descris descoperirea substanței și ia dat numele de „ozon“, în onoarea cuvântului grecesc „la miros.“
Abilitatea de a ucide ciupercile și bacteriile, precum și reducerea toxicității compușilor dăunători, care au avut o substanță deschisă, au interesat mulți oameni de știință. 17 ani de la deschiderea oficială a O3 Werner von Simens a proiectat primul aparat, care permite sintetizarea ozonului în orice cantitate. Și după încă 39 de ani, geniul Nikola Tesla a inventat și brevetat primul generator de ozon din lume.
Acest dispozitiv a fost folosit în Franța pentru prima dată după 2 ani la stațiile de epurare a apei potabile. Cu începutul secolului XX. Europa începe să treacă la ozonarea apei potabile pentru purificarea ei.
Imperiul rus a folosit prima dată această tehnică în 1911, iar după 5 ani au fost echipate în țară aproape patru duzini de instalații pentru purificarea apei potabile cu ozon.
Astăzi, ozonarea apei înlocuiește treptat clorurarea. Astfel, 95% din toată apa potabilă din Europa este curățată cu O3. Această metodă este, de asemenea, foarte populară în SUA. În CSI se află încă în stadiul de studiu, deoarece, deși această procedură este mai sigură și mai convenabilă, costă mai mult decât clorinarea.
Domenii de aplicare a ozonului
În plus față de purificarea apei, O3 are o serie de alte aplicații.
- Ozonul este utilizat ca un înălbitor în producția de hârtie și țesături.
- Oxigenul activ este folosit pentru a dezinfecta vinurile, precum și pentru a accelera procesul de coniacare "îmbătrânit".
- Cu ajutorul lui O3 diverse uleiuri vegetale sunt rafinate.
- De foarte multe ori, această substanță este utilizată pentru prelucrarea produselor perisabile, cum ar fi carnea, ouăle, fructele și legumele. Această procedură nu lasă urme chimice, ca și în cazul utilizării clorului sau formaldehidei, iar produsele pot fi stocate mult mai mult timp.
- Ozonul sterilizează echipamente medicale și îmbrăcăminte.
- De asemenea, se purifică O3 aplicați pentru diverse proceduri medicale și cosmetice. În special, se poate în stomatologie dezinfecta gura si gingiile, precum si tratarea bolilor diverse (stomatite, herpes, candidoză orală). În țările europene, O3 este foarte popular pentru dezinfectarea rănilor.
- În ultimii ani, aparatele portabile pentru filtrarea aerului și a apei cu ajutorul ozonului au devenit foarte populare.
Stratul de ozon - ce este?
La o distanță de 15-35 km deasupra suprafeței Pământului se află stratul de ozon sau, după cum se mai numește, ozonosfera. În acest loc concentrat O3 servește ca un fel de filtru pentru radiațiile solare dăunătoare. 
De unde provine această cantitate de materie, dacă moleculele sale sunt instabile? Răspunsul la această întrebare nu este dificil, dacă vă amintiți modelul moleculei de ozon și modul în care se formează. Deci, oxigenul, format din 2 molecule de oxigen, care intră în stratosfera, este încălzit acolo de razele soarelui. Această energie este suficientă pentru a împărți O2 pe atomii din care O3. În acest caz, stratul de ozon nu folosește numai o parte din energia solară, ci și îl filtrează, absoarbe ultravioletul periculos.
Sa spus mai sus că ozonul este dizolvat de freoni. Aceste substanțe gazoase (utilizate la fabricarea deodorantelor, extinctoare și frigidere), o dată în atmosferă, ozon afectează și promovează degradarea acesteia. Drept rezultat, apar găuri în ozonosferă prin care razele solare nefiltrate intră pe planetă, care sunt distrugătoare pentru organismele vii.
Având în vedere particularitățile și structura moleculelor de ozon, se poate ajunge la concluzia că această substanță, deși periculoasă, este foarte utilă umanității dacă este folosită corect.
 Terapia cu ozon. Numai recenzii
Terapia cu ozon. Numai recenzii Ozonul este un gaz de culoare albastră. Proprietăți și aplicarea gazului. Ozonul din atmosferă
Ozonul este un gaz de culoare albastră. Proprietăți și aplicarea gazului. Ozonul din atmosferă Formula chimică a ozonului. Formula structurală a ozonului
Formula chimică a ozonului. Formula structurală a ozonului De unde a provenit ozonul și rolul său în natură
De unde a provenit ozonul și rolul său în natură Depleția catastrofică a stratului de ozon
Depleția catastrofică a stratului de ozon Ozonoterapie: indicații și contraindicații
Ozonoterapie: indicații și contraindicații Dozatoare de ozon. Caracteristicile aplicației
Dozatoare de ozon. Caracteristicile aplicației Terapia cu ozon. Feedback asupra unei noi metode de tratament
Terapia cu ozon. Feedback asupra unei noi metode de tratament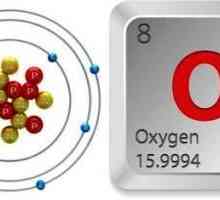 Modificări alotropice ale oxigenului: caracteristică și valoare comparativă
Modificări alotropice ale oxigenului: caracteristică și valoare comparativă Ozonoterapie pentru pierderea în greutate: o modalitate ușoară de a scăpa de kilogramele în plus
Ozonoterapie pentru pierderea în greutate: o modalitate ușoară de a scăpa de kilogramele în plus Unde este stratul de ozon? Care este stratul de ozon și de ce este distrugerea acestuia?
Unde este stratul de ozon? Care este stratul de ozon și de ce este distrugerea acestuia? Ozonul (element chimic): proprietăți, formulă, desemnare
Ozonul (element chimic): proprietăți, formulă, desemnare Ce este ozonul? Proprietățile și influența sa asupra activității umane
Ce este ozonul? Proprietățile și influența sa asupra activității umane Stratosfera este ce? Înălțimea stratosferei
Stratosfera este ce? Înălțimea stratosferei Are ozonoterapia contraindicații?
Are ozonoterapia contraindicații? Grupul Ozon din Republica Moldova: istoria creației, compoziția și cauza dezintegrării
Grupul Ozon din Republica Moldova: istoria creației, compoziția și cauza dezintegrării Generatoare de ozon: avantaje și caracteristici
Generatoare de ozon: avantaje și caracteristici Găurile de ozon - problema timpului nostru
Găurile de ozon - problema timpului nostru Ozonoterapia în cosmetologie este o alternativă la procedurile chirurgicale
Ozonoterapia în cosmetologie este o alternativă la procedurile chirurgicale Care este stratul de ozon?
Care este stratul de ozon? OZON.travel. Feedback asupra avantajelor acestei resurse
OZON.travel. Feedback asupra avantajelor acestei resurse
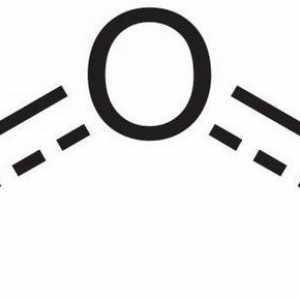 Ozonul este un gaz de culoare albastră. Proprietăți și aplicarea gazului. Ozonul din atmosferă
Ozonul este un gaz de culoare albastră. Proprietăți și aplicarea gazului. Ozonul din atmosferă Formula chimică a ozonului. Formula structurală a ozonului
Formula chimică a ozonului. Formula structurală a ozonului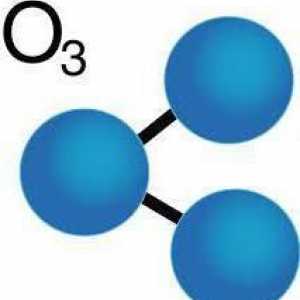 De unde a provenit ozonul și rolul său în natură
De unde a provenit ozonul și rolul său în natură Ozonoterapie: indicații și contraindicații
Ozonoterapie: indicații și contraindicații Dozatoare de ozon. Caracteristicile aplicației
Dozatoare de ozon. Caracteristicile aplicației Terapia cu ozon. Feedback asupra unei noi metode de tratament
Terapia cu ozon. Feedback asupra unei noi metode de tratament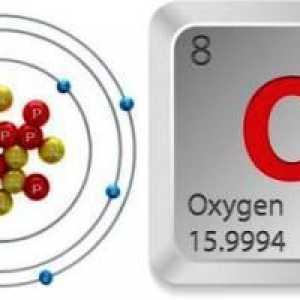 Modificări alotropice ale oxigenului: caracteristică și valoare comparativă
Modificări alotropice ale oxigenului: caracteristică și valoare comparativă Unde este stratul de ozon? Care este stratul de ozon și de ce este distrugerea acestuia?
Unde este stratul de ozon? Care este stratul de ozon și de ce este distrugerea acestuia?